Als Oktettregel bezeichnet man das Bestreben von Atomen, die im Periodensystem nächstgelegene Edelgaskonfiguration zu erreichen.
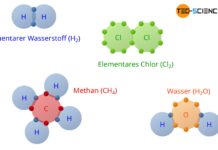
In der Natur treten Stoffe in den wenigsten Fällen als reine Elemente auf. Viel mehr gehen verschiedene Elemente aus energetischen Gründen Bindungen miteinander ein und bilden so chemische Verbindungen. Typisches Beispiel hierfür ist Wasser (H2O). In diesem Fall verbinden sich zwei Wasserstoffatome (2H) mit einem Sauerstoffatom (O) und bilden so ein stabiles Wassermolekül:
\begin{align}
\label{wasser}
& 2 H ~+~ O ~\rightarrow ~ H_2O \\[5px]
\end{align}
Bringt man die beiden Wasserstoffatome hingegen mit einem Argonatom (Ar) in Kontakt, so wird sich keine stabile Verbindung zwischen diesen Elementen ergeben. Vielmehr bleibt das Argonatom für sich und die beiden Wasserstoffatome verbinden sich zu elementarem Wasserstoff (H2):
\begin{align}
\label{argon}
& 2 H ~+~ Ar ~\rightarrow ~ H_2 ~+~ Ar \\[5px]
\end{align}
Weshalb sich manche Verbindungen ergeben und andere wiederum nicht, soll im Folgenden erläutert werden.
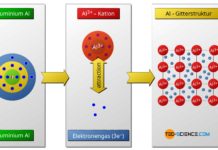
Betrachtet man die chemischen Elemente bezüglich ihres Bindungsverhaltens, so fällt vor allem bei den ganz rechts im Periodensystem stehenden Elemente der 8. Hauptgruppe auf, dass diese besonders stabil sind. Sie gehen praktisch keine chemischen Reaktionen mit anderen Atomen ein und bilden deshalb auch keine Moleküle, d.h. sie treten in der Natur nur einatomig auf.
Aus diesem Grund geht auch das oben beschriebene Argon keine chemische Bindung mit den beiden Wasserstoffatomen ein. Die Elemente der 8. Hauptgruppe sind bei Raumtemperatur alle gasförmig, was dieser Gruppe den Namen Edelgase verleiht. In Anlehnung ihres „trägen“ chemischen Verhaltens werden diese Gase auch als Inertgase bezeichnet (lat. iners= „träge“). Da diese Edelgase praktisch nicht mit anderen Stoffen reagieren, werden einige davon als Schutzgase gegen unerwünschte Oxidation beim Schweißen verwendet.
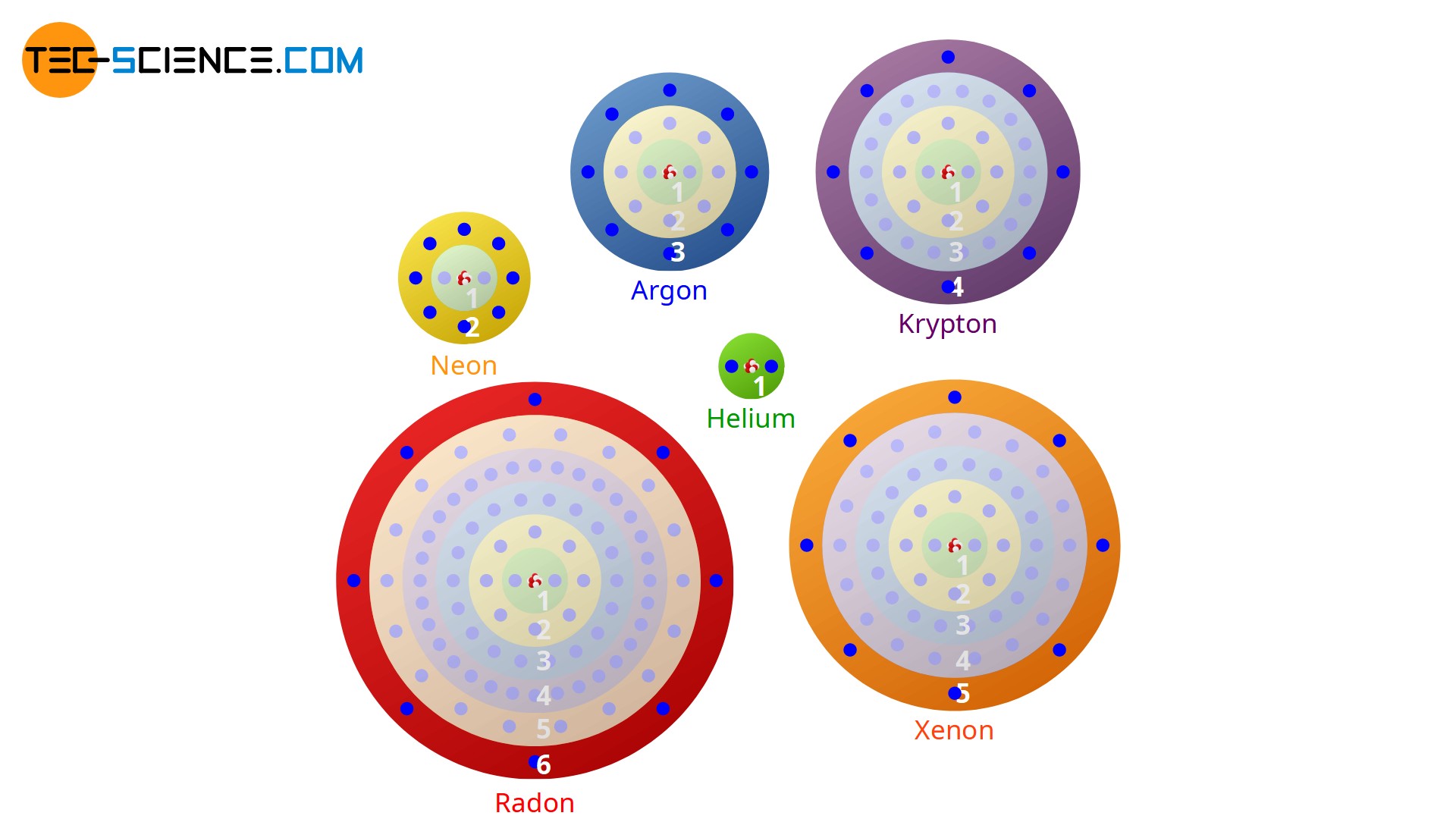
Da die Anzahl der Außenelektronen das chemische Verhalten eines Atoms entscheidend beeinflussen, bedeutet die Anzahl von acht Außenelektronen (bzw. zwei bei Helium) eine besonders stabile Elektronenbesetzung. Diese Elektronenkonfiguration ist energetisch offensichtlich sehr günstig. Auch die experimentellen Untersuchungen zum chemischen Bindungsverhalten von verschiedenen Atomen bestätigen diese Vermutung. So zeigt sich, dass Atome stets versuchen chemische Bindungen so einzugehen, dass sich um die beteiligten Atome jeweils acht bzw. zwei Außenelektronen bilden.
Man bezeichnet diesen Zustand eines Atoms innerhalb einer chemischen Bindung mit acht bzw. zwei Außenelektronen auch als Edelgaskonfiguration. Somit lässt sich eine wichtige Regel für das chemische Bindungsverhalten ableiten:
Jedes Atom hat das Bestreben die im Periodensystem nächstgelegene Edelgaskonfiguration zu erreichen (Oktettregel).
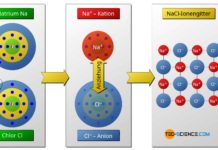
In Anlehnung an die Edelgase mit ihren acht Außenelektronen (Ausnahme: Helium) wird das Bestreben die Edelgaskonfiguration zu erzielen auch als Oktettregel bezeichnet. Der Edelgaszustand wird eben dadurch erreicht, dass die Atome chemische Bindungen eingehen und dabei Elektronen entweder …
- aufnehmen bzw. abgeben (Ionenbindung, Metallbindung), oder
- gemeinsam mit anderen Atomen verwenden (kovalente Bindung).
In den folgenden Kapiteln sollen die wichtigsten Bindungsarten in aller Kürze erläutert werden. Dabei ist stets zu beachten, dass Bindungen in der Realität nicht scharf auf eine Bindungsart begrenzt werden können. Vielmehr weisen chemische Verbindungen Merkmale verschiedener Bindungstypen auf.
Anmerkung
Fälschlicherweise wird im Kontext des Bohrschen Atommodell oft behauptet, dass die Edelgaskonfiguration eine vollbesetzte Außenschale bedeutet. Diese Aussage ist jedoch falsch! Denn im Atommodell nach Bohr ergibt sich die maximale Anzahl Elektronen auf der \(n\)-ten Schale nach folgender Formel (siehe Kapitel Bohrsches Atommodell):
\begin{equation}
N_{max} = 2 \cdot n^2
\end{equation}
Mit n=3 bietet Argon nach dem Bohrschen Atommodell auf seiner äußersten dritten Schale somit für maximal N=18 Elektronen Platz. Argon besitzt auf dieser Schale jedoch gerade einmal 8 Außenelektronen. Die äußerste Schale ist also bei weitem nicht voll besetzt! Es wird an dieser Stelle nämlich mit der falschen Modellvorstellung argumentiert. Vielmehr ist die Aussage der vollbesetzten (Unter-)Schale im Zusammenhang mit den von Sommerfeld eingeführten Orbitalen zu sehen (Sommerfeld-Erweiterung):
Die Edelgaskonfiguration bedeutet ein voll besetztes Orbital (Unterschale) im Bohr-Sommerfeld-Modell!
Genauer gesagt handelt es sich bei der Edelgaskonfiguration um ein vollbesetztes p-Orbital. Ausnahme bildet Helium mit einem vollbesetztes s-Orbital.