Die spezifische Wärmekapazität von Wasser ist von der Temperatur abhängig und stark abhängig vom Aggregatzustand.
Die spezifische Wärmekapazität ist keine reine Stoffkonstante, sondern je hängt von der Temperatur und vor allem vom Aggregatzustand des Stoffes ab. Am Beispiel von Wasser soll die Abhängigkeit der spezifischen Wärmekapazität vom Aggregatzustand und von der Temperatur gezeigt werden.
Das Minimum der spezifischen Wärmekapazität von flüssigem Wasser mit rund 4,18 kJ/(kg⋅K) liegt bei einer Temperatur von 40 °C und das Maximum mit ca. 4,22 kJ/(kg⋅K) bei einer Temperatur von 0 °C. Wird für flüssiges Wasser ein Durchschnittswert von 4,2 kJ/(kg⋅K) angenommen, so beträgt die Abweichung zum Maximal- bzw. Minimalwert weniger als 1 %! Aus diesem Grund kann für viele Fälle die spezifische Wärmekapazität von flüssigem Wasser tatsächlich als nahezu konstant angenommen werden.
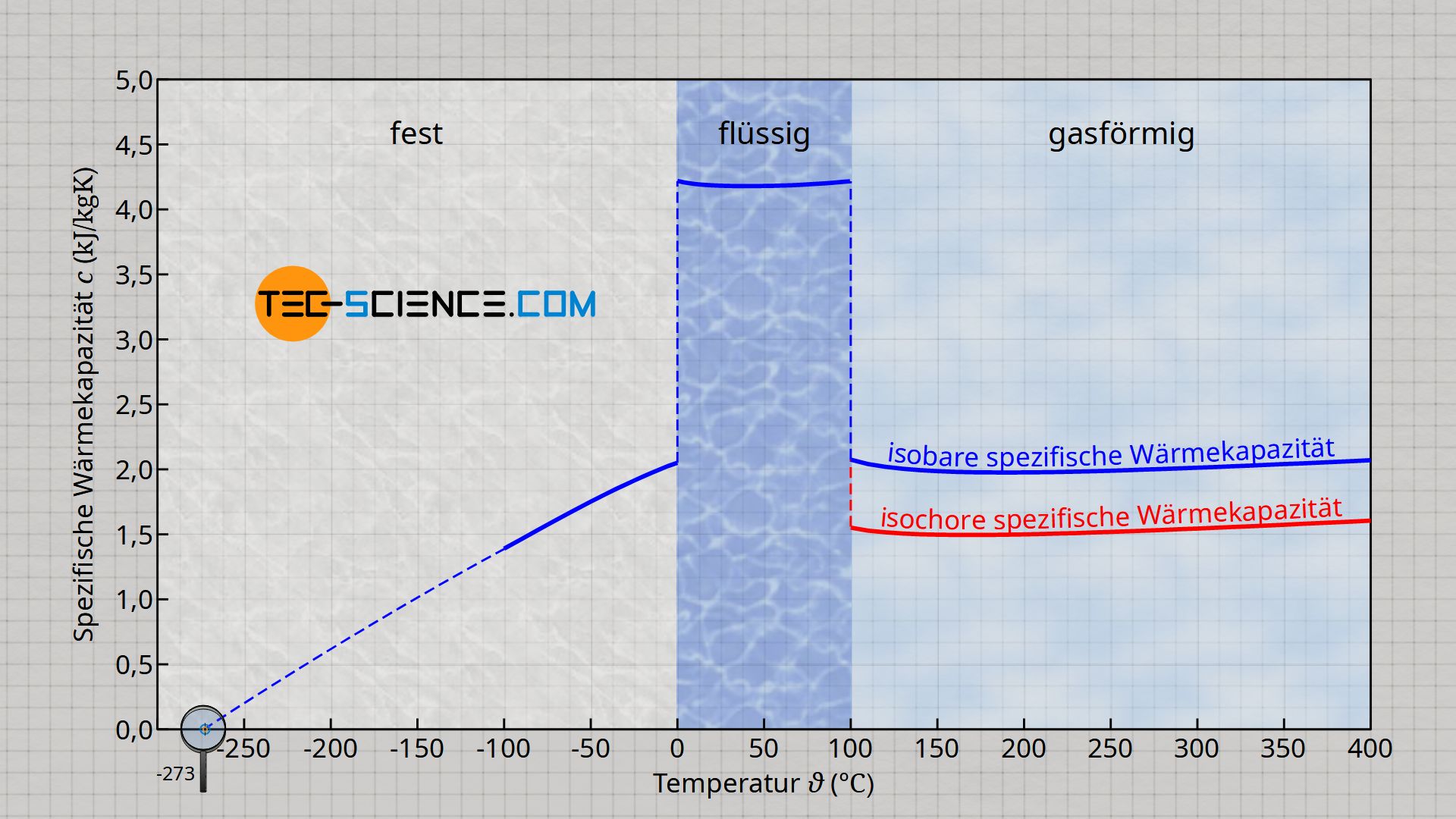
Das obere Diagramm zeigt für Wasser den Verlauf der spezifischen Wärmekapazität in Abhängigkeit der Temperatur für verschiedene Aggregatzustände. Dabei wird deutlich, dass sich beim Wechsel des Aggregatzustandes die spezifische Wärmekapazität stark ändert. So besitzt gasförmiges Wasser mit einer spezifischen (isobaren) Wärmekapazität von etwa 2,02 kJ/(kg⋅K) nur rund die Hälfte des Wertes von flüssigem Wasser. Aber auch für diesen Aggregatzustand gilt, dass die spezifische Wärmekapazität als nahezu unabhängig von der Temperatur betrachtet werden kann.
Anders sieht dies für festes Wasser (Eis) aus. In diesem Fall ändert sich die spezifische Wärmekapazität sehr stark mit der Temperatur. Für niedrige Temperaturen nimmt diese immer mehr ab und ist am absoluten Nullpunkt sogar null! Ein solches Verhalten gilt im Übrigen nicht nur für Wasser sondern es zeigt sich bei jedem Stoff, dass die spezifische Wärmekapazität am absoluten Nullpunkt null beträgt!
Die spezifische Wärmekapazität von Stoffen ist am absoluten Nullpunkt ebenfalls Null!
Im gasförmigen Zustand des Wassers muss (wie auch bei allen anderen kompressiblen Stoffen) unterschieden werden, ob die Wärmeübertragung bei konstantem Druck oder bei konstantem Volumen stattfindet. Dementsprechend unterscheidet man zwischen der isobaren spezifische Wärmekapazität cp und der isochoren spezifischen Wärmekapazität cv. Die isobare spezifische Wärmekapazität ist dabei stets größer als die isochore spezifische Wärmekapazität. Mehr Informationen spezielle hierzu, finden sich im Artikel Spezifische Wärmekapazität von Gasen (bei konstantem Druck bzw. Volumen).