Während der Änderung des Aggregatzustandes wird die zugeführte Energie nicht zur Erhöhung der Bewegungsenergie der Teilchen genutzt, sondern zur Änderung der Bindungsenergien.
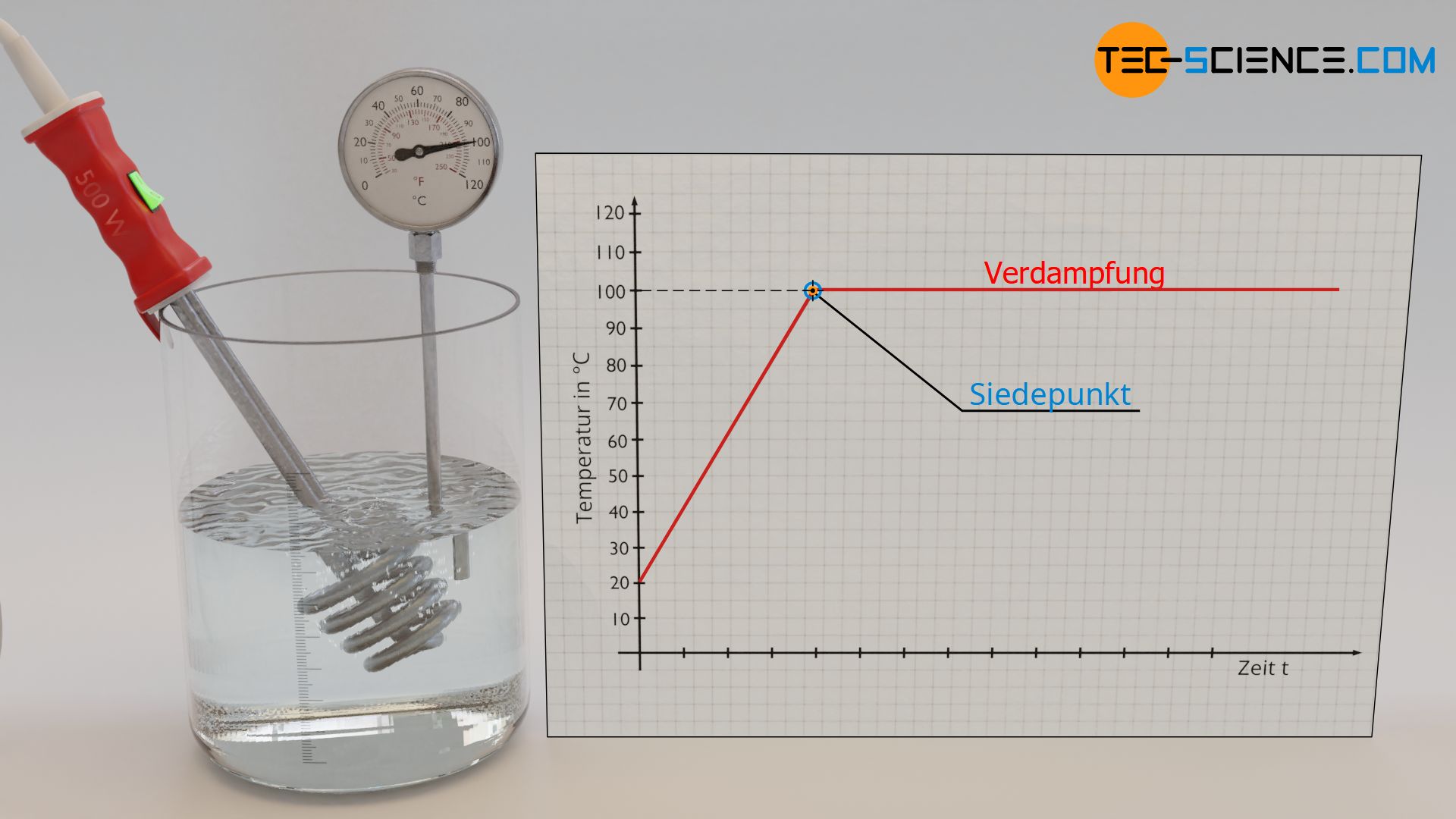
Konstante Temperatur beim Verdampfen und Schmelzen
Wird Wasser mit einem Tauchsieder erhitzt, so beobachtet man zunächst einen Temperaturanstieg. Dies ändert sich jedoch, wenn das Wasser zu Sieden beginnt. Während des Verdampfens erhöht sich die Temperatur nicht weiter. Das Thermometer verharrt bei einer Siedetemperatur von 100 °C, und dies obwohl durch den Tauchsieder offensichtlich weiter Wärme zugeführt wird.
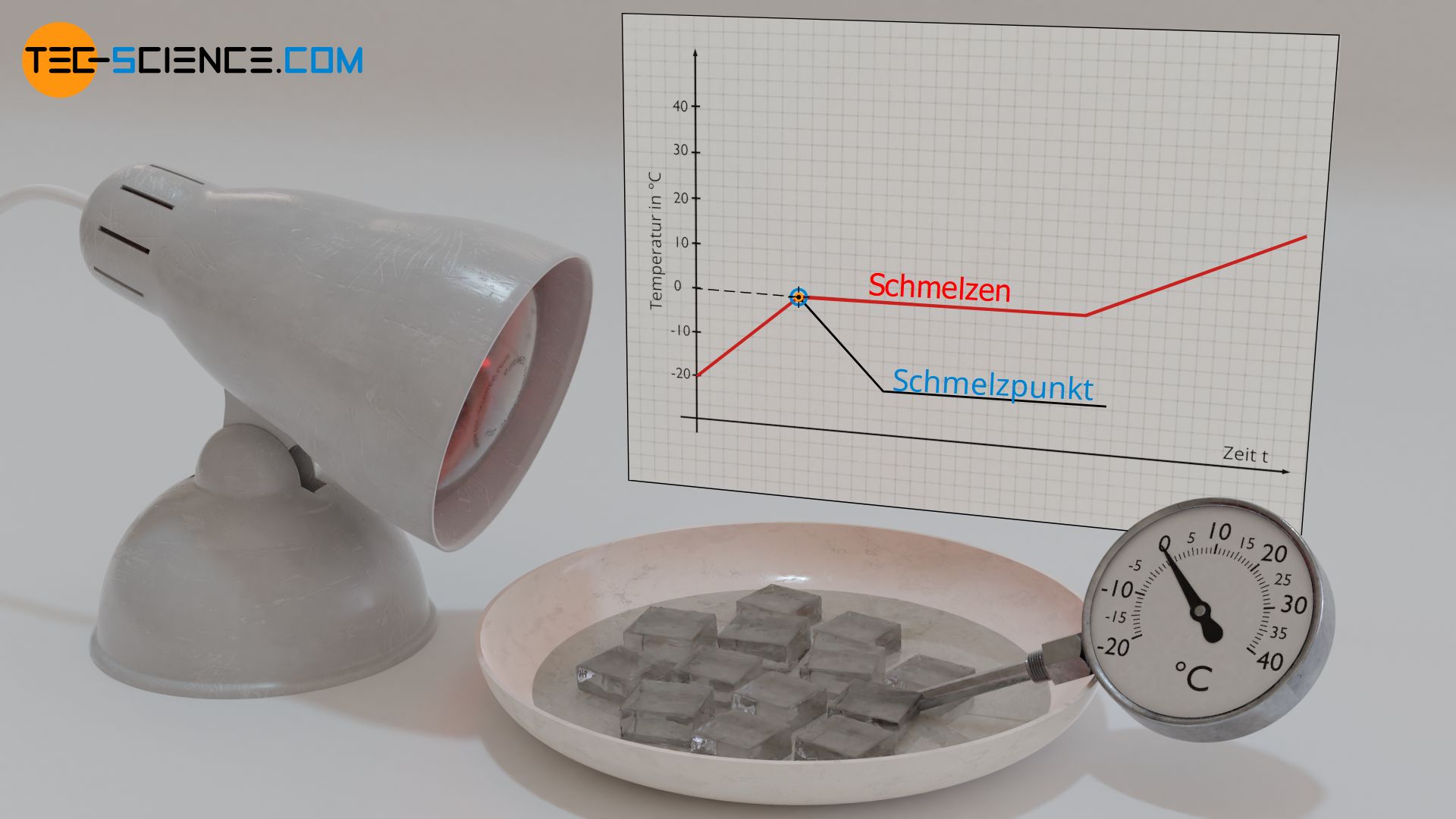
Ein Ähnliches Verhalten kann beim Schmelzen von Eis beobachtet werden. Um dies zu demonstrieren, gibt man Eiswürfel aus dem Kühlfach in eine Schüssel und erwärmt diese zum Beispiel mit einer Wärmelampe. Durch die Wärmezufuhr steigt die Temperatur der Eiswürfel wie gewohnt an. Fängt das Eis bei einer Temperatur von 0 °C allerdings an zu Schmelzen, dann erhöht sich die Temperatur des Wasser-Eis-Gemisches nicht weiter. Das Thermometer verharrt bei einer Schmelztemperatur von 0 °C, und dies obwohl durch die Wärmelampe offensichtlich weiter Wärme zugeführt wird. Erst wenn sich alles Eis verflüssigt hat, erhöht sich die Temperatur wieder.
Nicht nur beim Schmelzen oder Verdampfen von Wasser bleiben die Temperaturen konstant, sondern auch in den umgekehrten Fällen, d.h. beim Erstarren bzw. Kondensieren. Offensichtlich zeigt sich dieses Phänomen der konstanten Temperatur im Allgemeinen bei Aggregatzustandsänderungen (auch als Phasenübergang oder Phasenänderung bezeichnet). Dies gilt dabei nicht nur für Wasser, sondern kann bei allen Reinstoffen beobachtet werden.
Es stellt sich die Frage, warum sich die Temperatur trotzt Energiezufuhr bzw. Energieabfuhr bei einer Aggregatzustandsänderung nicht ändert. Und ist dies auch bei Stoffgemischen der Fall?
Ursache der Temperaturerhöhung bei Wärmezufuhr
Wird einem Stoff Energie in Form von Wärme zugeführt, dann für dies dazu, dass sich die darin enthaltenen Teilchen heftiger bewegen. In Festkörper nimmt zum Beispiel durch eine Wärmezufuhr die Schwingung der Atome zur. In Flüssigkeiten und Gasen erhöht sich durch Wärmezufuhr die Bewegungsenergie und somit die Geschwindigkeit der Teilchen. Da die Temperatur eines Stoffes ein Maß für die Bewegungsenergie der darin enthaltenen Teilchen ist, lässt sich auf diese Weise die im Allgemeinen beobachtbare Zunahme der Temperatur bei einer Wärmezufuhr erklären (siehe hierzu auch Artikel Temperatur und Teilchenbewegung).
Da bei Aggregatzustandsänderungen hingegen die Temperatur konstant bleibt, kann die zugeführte Energie offensichtlich nicht mehr der Bewegungsenergie der Teilchen zugutekommen. Am Beispiel eines Verdampfungsvorgangs werden die atomaren Vorgänge im Folgenden exemplarisch näher erläutert.
Atomare Vorgänge beim Verdampfen
Im flüssigen Zustand sind die einzelnen Moleküle durch zwischenmolekulare Kräfte miteinander verbunden (Van-der-Waals-Kräfte). Diese Kräfte sorgen dafür, dass sich die Moleküle in der Flüssigkeit nicht wie bei Gasen frei im gesamten Raum verteilen, sondern eine zusammenhängende Masse bilden. Man kann sich die intermolekularen Bindungskräfte wie Gummibänder vorstellen, die die Moleküle der Flüssigkeit zusammenhalten.
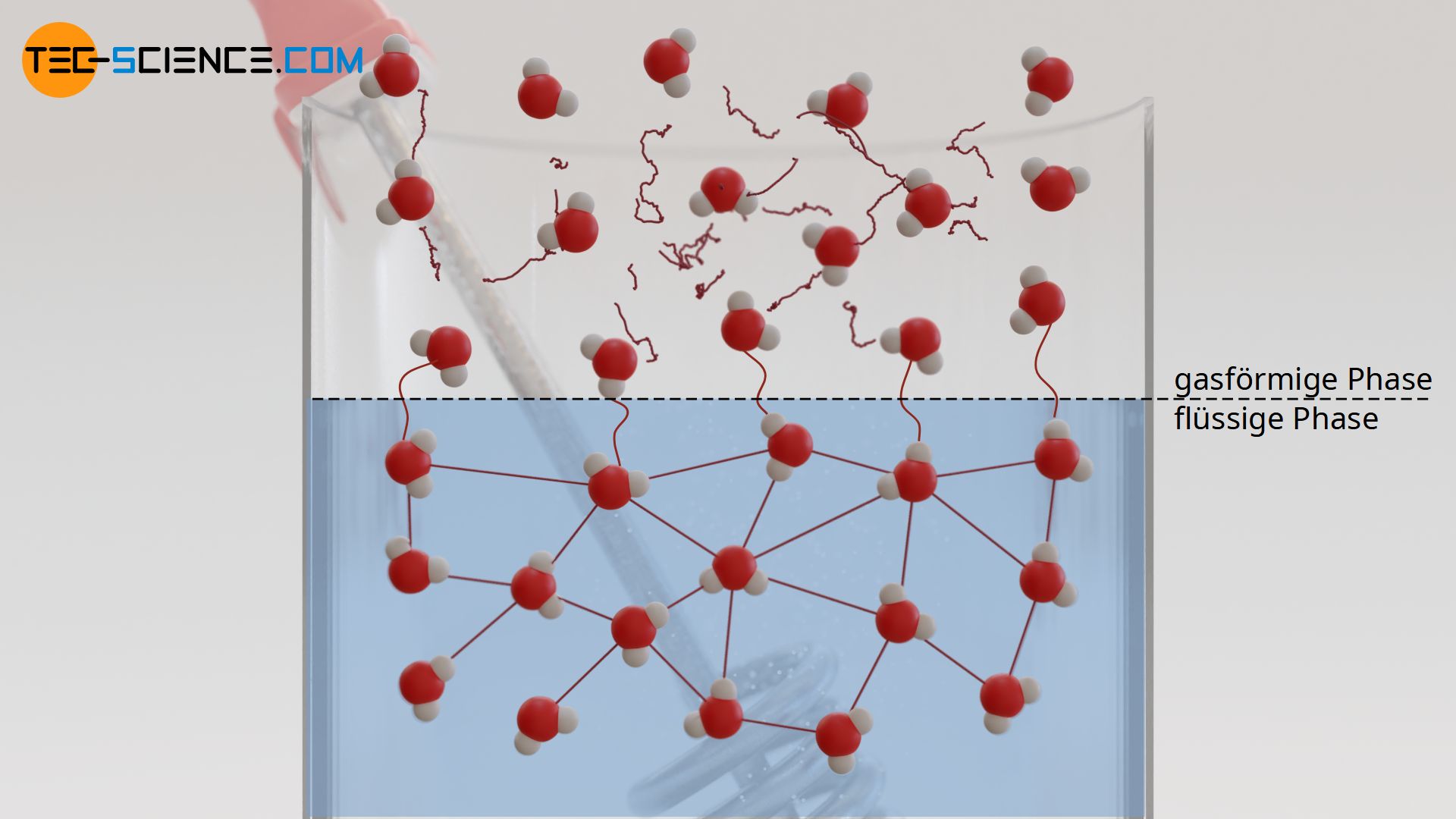
Wird die Flüssigkeit nun erwärmt, so werden die Bindungskräfte durch die stärker werdenden Teilchenbewegungen mehr und mehr gelockert. Im übertragenen Sinne entspräche dies einem Überdehnen der Gummibänder aufgrund der zunehmenden Bewegung (größerer Abstand). Irgendwann wird die Bewegung so stark sein, dass Gummibänder regelrecht ausleiern und damit an Elastizität verlieren. Der Siedepunkt der Flüssigkeit ist in diesem Zustand erreicht und die Moleküle sind kaum noch elastisch miteinander verbunden.
In diesem Siedepunkt sind die Bewegungsenergien einzelner Moleküle größer als die Bindungsenergien zwischen den Molekülen. Die Bewegung der Moleküle ist sozusagen stärker als die Bindung zwischen den Molekülen. Dies entspräche in der Modellvorstellung jenem Punkt, in dem die Teilchen genügend Energie besitzen, um die Gummibänder zu zerreißen, die sie normalerweise zusammenhalten. Jene Moleküle, die sich von den Bindungen losgerissen haben, können sich nun frei bewegen und sind nicht mehr an die Flüssigkeit gebunden – sie sind gasförmig geworden. Die Flüssigkeit geht allmählich in den gasförmigen Zustand über und wird geringer.
Beachte, dass im Allgemeinen auch im gasförmigen Zustand zwischenmolekulare Bindungskräfte wirken, dies sind jedoch im Vergleich zu den Bindungskräften im flüssigen oder festen Zustand deutlich geringer!
Die zugeführte Wärmeenergie während des Verdampfens kommt also deshalb nicht der Erhöhung der Bewegungsenergie und damit der Erhöhung der Temperatur zugute, weil die zugeführte Wärmeenergie für das Losreißen der Moleküle von den intermolekularen Bindungskräften genutzt wird (Änderung der Inneren Energie). Deshalb bleibt die Temperatur während einer Verdampfung solange konstant, bis die Aggregatzustandsänderung vollständig abgeschlossen ist. Erst anschließend kann die Bewegungsenergie bzw. die Temperatur des nun vollständig gasförmigen Stoffes durch weitere Wärmezufuhr weiter erhöht werden.
Während der Änderung des Aggregatzustandes wird die zugeführte Energie nicht zur Erhöhung der Bewegungsenergie der Teilchen genutzt, sondern zur Änderung der Bindungsenergien (Erhöhung der Inneren Energie)!
Die zur vollständigen Verdampfung einer Flüssigkeit notwendige Wärmeenergie wird Verdampfungswärme genannt. Mehr Informationen speziell hierzu finden sich im Artikel Spezifische Verdampfungswärme und Kondensationswärme (latente Wärme).
Atomare Vorgänge beim Kondensieren
Kondensiert ein flüssiger Stoff, so gibt dieser die zuvor aufgenommene Verdampfungswärme wieder als Kondensationswärme ab. Diesen Vorgang kann man sich ebenfalls mit Gummibändern veranschaulichen. Während die Teilchen in der Gasphase relativ frei beweglich sind, werden die Teilchen im flüssigen Zustand von intermolekularen Kräften zusammengehalten. Der Kondensationsvorgang entspricht somit dem Einfangen der Moleküle mithilfe von Gummibändern. Die wild umherfliegenden Moleküle schlagen dabei mit voller Wucht auf das dichtere Netzwerk der bereits eingefangenen Moleküle der Flüssigkeitsphase.
Beim Aufprall wird ein Teil der ursprünglichen Bewegungsenergie auf die Moleküle der Flüssigkeit übertragen. Damit dabei allerdings nicht wieder bereits eingefangene Moleküle herausgeschlagen werden, muss diesen zusätzlich Energie entzogen werden. Dies entspräche im übertragenen Sinne dem Abführen der Kondensationsenergie, damit der kondensierte Stoff auch dauerhaft flüssig bleibt und sich die darin befindlichen Teilchen nicht wieder von der Flüssigkeitsphase losreißen können.
Einerseits findet also ein Energieübertrag während des Aufpralls von den Teilchen der Gasphase auf die Teilchen der Flüssigkeitsphase statt, andererseits wird jedoch Energie in Form von (Kondensations-)Wärme abgeführt, um die Teilchen dauerhaft aneinander binden zu können. Die im Inneren freiwerdende Aufprallenergie wird durch die von außen abgeführte Kondensationswärme schließlich vollständig kompensiert. Obwohl von außen also Kondensationswärme abgeführt wird, kommt es aufgrund der gleichzeitigen inneren Wärmefreisetzung deshalb nicht zu einer Temperaturerniedrigung.
Erst wenn der Kondensationsvorgang vollständig abgeschlossen und alle Teilchen wieder aneinander gebunden sind und somit keine innere Aufprallenergie mehr freigesetzt wird, führt eine äußere Wärmeabfuhr wieder zu einer Temperaturerniedrigung.
Atomare Vorgänge beim Schmelzen und Erstarren
Nicht nur beim Übergang von der flüssigen in die gasförmige Phase (oder umgekehrt) ändern sich die Bindungsenergien zwischen den Molekülen sprunghaft. Auch beim Übergang vom festen in den flüssigen Zustand, tritt eine sprunghafte Änderung der Bindungsenergie auf. Während die Moleküle im festen Zustand aufgrund der hohen Bindungskräfte fest ein einen bestimmten Ort gebunden sind, können sich die Moleküle in der Flüssigkeit aufgrund der nur schwach ausgeprägten Bindungskräfte relativ frei bewegen.
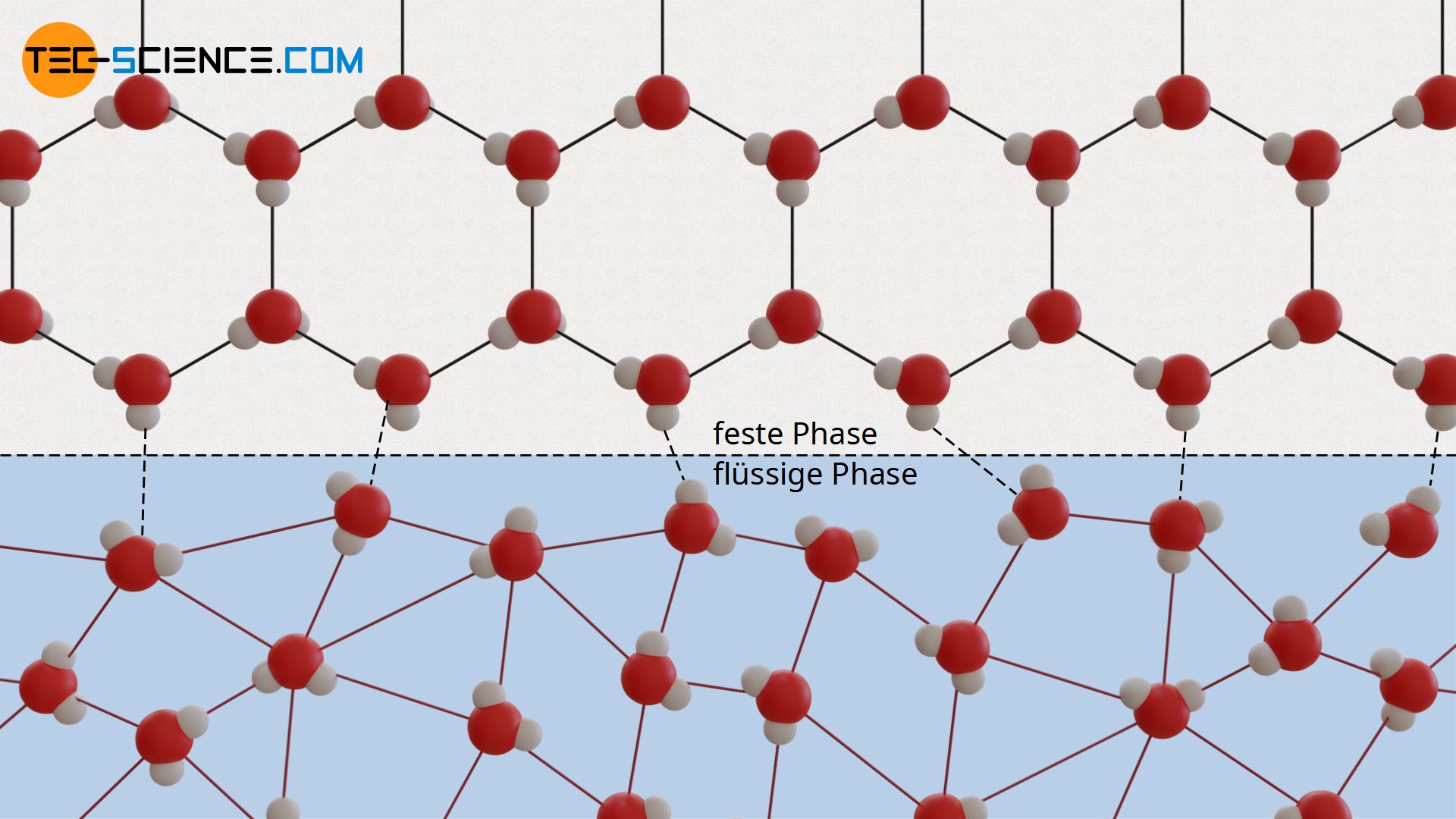
Um die Moleküle während des Schmelzens von den starken Bindungskräften loszureißen ist folglich ebenfalls Energie notwendig. Diese wird durch die Wärmezufuhr beim Schmelzen aufgebracht und führt solange nicht zu einer weiteren Erhöhung der Temperatur, bis alle intermolekularen Bindungen aufgebrochen sind und der Stoff geschmolzen ist. Erst dann steht die zugeführte Wärmeenergie wieder für die Erhöhung der Bewegungsenergie zur Verfügung – die Temperatur der Flüssigkeit steigt.
Die zum vollständigen Schmelzen eines Stoffes notwendige Wärmeenergie wird Schmelzwärme genannt. Mehr Informationen speziell hierzu finden sich im Artikel Spezifische Schmelzwärme und Erstarrungswärme (latente Wärme).
Im umgekehrten Fall, d.h. bei einem Erstarrungsvorgang, muss die zuvor zugeführte Schmelzwärme wieder in Form von Erstarrungswärme abgeführt werden, um den flüssigen Stoff vollständig zu erstarren. Auch dabei bleibt die Temperatur wieder solange konstant, bis die Flüssigkeit vollständig erstarrt ist.
Aggregatzustandsänderungen bei nicht konstantem Druck
Im Artikel Warum kocht Wasser in großen Höhen früher? wurde bereits ausführlich erläutert, dass sich die Siedetemperatur mit dem Umgebungsdruck ändert. Eine solche Druckabhängigkeit gilt nicht nur für das Verdampfen bzw. Kondensieren, sondern für jede Art der Aggregatzustandsänderung, d.h. auch die Schmelztemperaturen bzw. Erstarrungstemperaturen sind druckabhängig. Deshalb bleibt die Temperatur bei Aggregatzustandsänderung auch nur dann konstant, wenn gleichzeitig der Druck konstant bleit.
Würde man zum Beispiel Wasser in einem Schnellkochtopf zum Kochen bringen, dann bleibe die Temperatur beim Sieden nicht mehr konstant. Ein Schnellkochtopf schließt den Topf mit Wasser nämlich gasdicht ab. Im Vergleich zu flüssigem Wasser nimmt gasförmiges Wasser jedoch ein größeres Volumen ein. In einem Schnellkochtopf kann sich das gasförmige Wasser jedoch nicht ausdehnen. Der Druck steigt deshalb mit zunehmender Verdampfung des Wassers kontinuierlich an (ein Überdruckventil begrenzt den Druck in Schnellkochtöpfen meist auf maximal 2 bar). Mit der kontinuierlichen Erhöhung des Drucks steigt auch die Siedetemperatur während der Verdampfung permanent an. Die Temperatur bleibt in diesem Fall folglich nicht konstant.

Bei Aggregatzustandsänderungen von Reinstoffen bleibt die Temperatur nur dann konstant, wenn gleichzeitig der Druck konstant gehalten wird (isobarer Prozess)!
Aggregatzustandsänderungen von Stoffgemischen
Während bei Aggregatzustandsänderungen von Reinstoffen die Temperatur tatsächlich konstant bleibt, findet bei Stoffgemischen meist lediglich eine Verlangsamung der Temperaturänderung statt. In diesem Fall wird nur ein Teil der Wärmeenergie für die Änderung der Bindungsenergien genutzt, während die restliche Wärme gleichzeitig für eine Temperaturänderung sorgt. Es ist also keineswegs so, dass bei allen Stoffen die Temperatur während Phasenübergängen konstant bleibt.
Bei Stoffgemischen bleibt die Temperatur bei Aggregatzustandsänderungen im Allgemeinen nicht mehr konstant, sondern die Temperaturänderung verlangsamt sich dabei lediglich!






