Wasser entzieht der Brandstelle durch die Aufnahme einer sehr großen Wärmemenge beim Verdampfen, der Brandstelle Energie und kühlt sie somit aus, bis das Feuer erlischt!
Die einfache Antwort auf diese Wäre würde lauten: Wasser kühlt die Brandstelle und erlischt somit das Feuer. Man könnte nun aber argumentieren: Wenn das auf die Brandstelle gegossene Wasser heiß wird und verdampft, dann ist die Kühlwirkung nicht mehr da. Demzufolge sollte das Verdampfen des Wassers doch hinderlich sein, wenn man Feuer löschen möchte – oder? Tatsächlich ist aber genau das Gegenteil der Fall: Besonders das Verdampfen des Wassers spielt eine zentrale Rolle für die hervorragende Löschwirkung! Um dies zu verstehen, betrachten wir den Verdampfungsvorgang des Wassers etwas genauer.

Um Wasser zu verdampfen, muss es zunächst auf Siedetemperatur erhitzt werden. Das Erwärmen von einem Kilogramm Wasser von 20 °C auf 100 °C macht eine Wärmeenergie von 336 kJ erforderlich. Für das anschließende Verdampfen muss nochmals weitere Wärmeenergie aufgewendet werden, um die intermolekularen Bindungen aufzubrechen, die die Wassermoleküle in der flüssigen Phase zusammenhalten. Das vollständige Aufbrechen dieser Wasserstoffbrückenbindung benötigt weitere 2257 kJ an Wärmeenergie. Diese für das Verdampfen erforderliche Wärmeenergie wird auch als Verdampfungswärme bezeichnet. Das Verdampfen des Wassers erfordert also mehr als 6-mal so viel Wärmeenergie als für die Erwärmung auf Siedetemperatur aufgewendet werden musste.
Wasser benötigt zum Verdampfen ein Vielfaches der Wärmemenge im Vergleich zur Erwärmung auf Siedetemperatur!
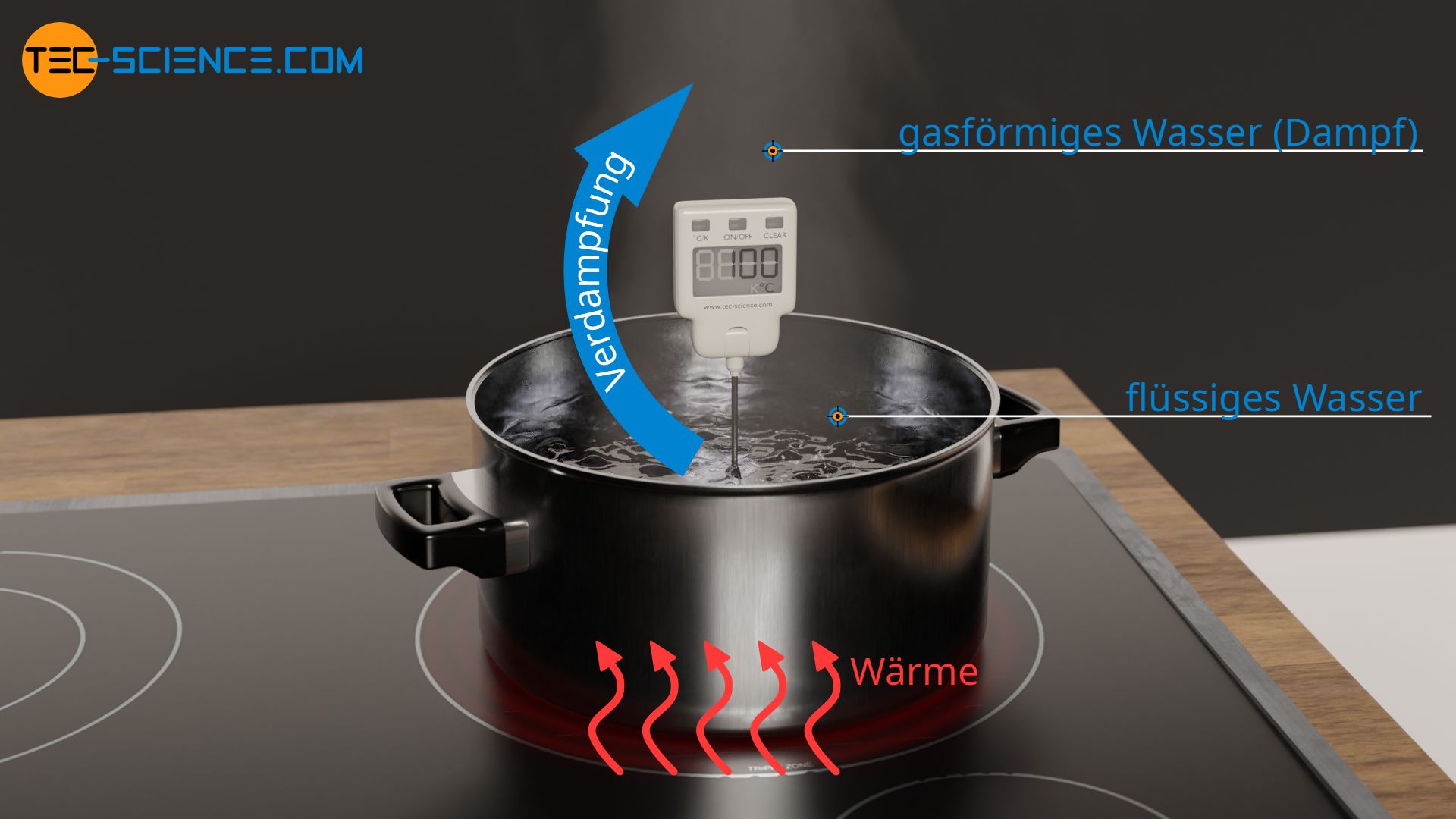
Die sehr große Verdampfungswärme von Wasser ist der Grund, weshalb sich das Wasser in besonderer Weise als Löschmittel für die Brandbekämpfung eignet. Wird Wasser auf die Brandstelle gegossen, so wird das Wasser nicht nur erwärmt, sondern auch verdampft. Wie erläutert, benötigt das Wasser speziell für das Verdampfen sehr viel Wärme. Diese Wärmeenergie liefert die Brandstelle. Umgekehrt bedeutet dies, dass dem brennenden Stoff durch die Verdampfung des Wassers sehr viel Energie in Form von Wärme entzogen wird. Hierdurch kühlt die Brandstelle aus und die Temperatur sinkt. Fällt die Temperatur schließlich unterhalb des Zündpunktes des brennenden Stoffs, so erlischt das Feuer.
Wasser entzieht durch die Aufnahme einer sehr großen Wärmemenge beim Verdampfen, der Brandstelle Energie und kühlt sie somit aus, bis das Feuer erlischt!
Würde das Wasser beim Löschen eines Feuers nicht verdampfen, sondern sich nur erwärmen, dann würde das Wasser aufgrund der ausbleibenden Verdampfungswärme nicht die enorme Wärmeenergie der Brandstelle entziehen. Das Wasser hätte somit längst nicht die Kühlwirkung und damit den gewünschten Löscheffekt. Das Verdampfen des Wassers ist also wesentlich, wenn es um das Löschen mit Wasser geht. Die Temperatur des Wassers, mit der ein Brand gelöscht wird, spielt dabei eine vernachlässigbare Rolle. Auch kochendes Wasser eignet sich für die Brandbekämpfung (zumindest, wenn es um Brände geht, die mit Wasser gelöscht werden können – bei Metallbränden darf bspw. kein Wasser verwendet werden, da sich dieses zersetzt und sich dabei hochexplosives Knallgas bildet!).

Tatsächlich ist die gute Löschwirkung von Wasser nicht nur auf die große Verdampfungswärme zurückzuführen. Auch die Tatsache, dass sich Wasser beim Verdampfen stark ausdehnt, spielt eine wichtige Rolle. Aus einem Liter flüssigem Wasser, werden bei gleichbleibendem Druck rund 1700 Liter Wasserdampf. Diese enorme Volumenzunahme beim Verdampfen verdrängt den für die Verbrennung notwendigen Sauerstoff von der Brandstelle und das Feuer erstickt. Besonders Effektiv geschieht dies, wenn das flüssige Wasser in feine Tropfen vernebelt wird und auf die Brandstelle gesprüht wird. In in diesem Fall können sogar Öl- oder Fettbrände mit dem feinen Wassernebel gelöscht werden, die nicht normalerweise mit flüssigem Wasser gelöscht werden dürfen. Denn in diesem Fall verdampfen die feinen Wassertropfen bevor sie in Kontakt mit dem brennenden Öl kommen. Damit wird verhindert, dass das Öl durch verdampfendes Wasser mit in die Luft gerissen wird.