Als Dichteanomalie bezeichnet man das paradoxe Verhalten eines Stoffes sich bei Abkühlung plötzlich wieder auszudehnen (Abnahme der Dichte), anstelle sich weiter zusammenzuziehen.
Dichteanomalie von Wasser
Wasser verhält sich beim Abkühlung aufgrund seiner besonderen molekularen Struktur anders als die meisten anderen Stoffe. Um dies zu verdeutlichen sind in der unteren Abbildung mehrere Reagenzgläser gezeigt, die jeweils identisch gefüllt sind. Nun wird das in den Gefäßen enthaltene Wasser mehr und mehr abgekühlt. Dabei zeigt sich zunächst das gewohnte Verhalten, dass sich das Wasser aufgrund der abnehmenden Wärmebewegung mehr und mehr zusammenzieht. Das Volumen des Wassers nimmt erwartungsgemäß ab bzw. die Dichte steigt. Beachte, dass sich Volumen und Dichte genau umgekehrt zueinander verhalten.

Unterhalb von 4 °C verhält sich Wasser jedoch anders als die meisten Flüssigkeiten. Das Volumen nimmt bei weiterer Abkühlung nun nicht wie gewohnt ab, sondern zu. Die Dichte sinkt in diesem Temperaturbereich entsprechend wieder ab. Dieses Phänomen bezeichnet man als Anomalie des Wassers oder allgemein als Dichteanomalie. Wasser besitzt folglich bei 4 °C (genauer: 3,98 °C) das geringste Volumen bzw. seine größte Dichte mit 0,99997 g/cm³! Eine solche Dichteanomalie zeigt allerdings nicht nur Wasser, sondern auch andere Stoffe wie bspw. Silizium oder Germanium.
Als Dichteanomalie bezeichnet man das paradoxe Verhalten eines Stoffes sich bei Abkühlung plötzlich wieder auszudehnen (Abnahme der Dichte), anstelle sich weiter zusammenzuziehen!
Die Dichteanomalie ist für das Leben auf der Erde entscheidend! Dies führt unter anderem nämlich dazu, dass ein See von oben zugefriert und nicht beginnend am Grund des See. Somit bleibt das Wasser unter der Eisschicht meist noch flüssig und erlaubt somit das Überleben der Fische im Winter.
Ursache der Dichteanomalie
Grund für die Dichteanomalie des Wassers sind sogenannte Cluster. Dies sind Ansammlungen von Wassermoleküle, die durch Wasserstoffbrückenbindungen zusammengehalten werden. Solche Cluster können sich allerdings nur bei relativ niedrigen Temperaturen stabil bilden. Bei zu hohen Temperaturen ist die Wärmebewegung so stark, dass die Cluster aufgrund der nur schwach ausgeprägten Wasserstoffbrückenbindungen wieder entrissen werden. Umgekehrt nimmt mit sinkender Temperatur die Teilchenbewegung der einzelnen Wassermoleküle ab, sodass sich mehr Wasserteilchen an die Cluster anlagern können, ohne dass diese aufgrund zu hoher Bewegungsenergien sofort wieder weggerissen werden.
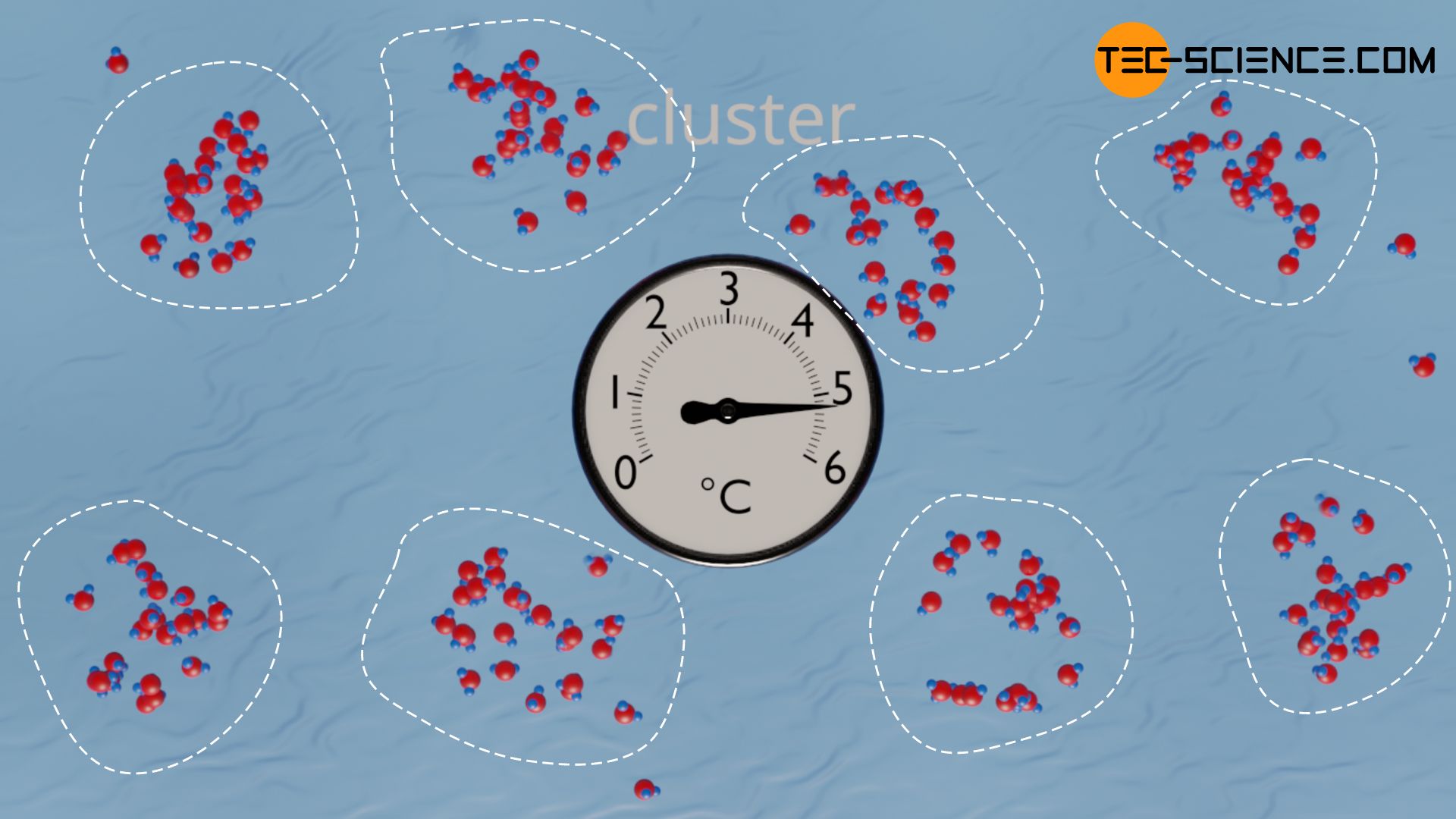
Die einzelnen Cluster werden mit sinkender Temperatur also immer größer und der Raumbedarf der Cluster nimmt entsprechend zu. Gleichzeitig rücken allerdings die einzelnen Cluster aufgrund des Effekts der Wärmeausdehnung mit sinkender Temperatur näher zusammen. Letzterer Effekt dominiert zunächst, sodass sich das Volumen des Wassers insgesamt betrachtet zusammenzieht.
Schließlich nimmt bei weiterer Absenkung der Temperatur das Volumen der Cluster überproportional zu und kompensiert allmählich den Effekt des thermischen Zusammenziehens der einzelnen Cluster. Bei 3,98 °C ist der Effekt der wachsenden Cluster genauso groß wie der Effekt des thermischen Zusammenziehens. In diesem Punkt besitzt das Wasser das geringste Volumen bzw. die größte Dichte. Bei weiterer Temperaturabsenkung unter 3,98 °C übersteigt der Effekt des vergrößerten Raumbedarfs der wachsenden Cluster den Effekt des thermischen Zusammenziehens und das Wasservolumen steigt wieder an.
Bei weiterer Abkühlung nahe dem Erstarrungspunkt werden die Cluster immer größer und größer und die Wasserstoffbrückenbindungen gegenüber der Wärmebewegung stabiler. Die Cluster weisen deshalb allmählich Kristallstrukturen von festem Eis auf. Diese sind jedoch noch nicht stabil und zerfallen bereits nach kurzer Zeit wieder (erst beim Gefrieren sind die Wasserstoffbrückenbindungen stabil). Grundsätzlich beträgt die Lebensdauer der einzelnen Cluster in diesem instabilen Zustand in der Regel nur wenige billionstel Sekunden. Während sich an einer Stelle solche Cluster also rasch wieder auflösen, sammeln sich dafür an anderer Stelle wieder Wassermoleküle zu einem neuen Cluster zusammen.
Dichtesprung beim Erstarren
Wird das Wasser weiter abgekühlt, dann erstarrt es schließlich 0 °C zu einer festen Struktur mit stabilen Wasserstoffbrückenbindungen. Bei diesem Phasenübergang bilden sich aufgrund der gewinkelten H2O-Moleküle sechseckige Strukturen. Inmitten dieser Strukturen ist sehr viel „leere“ Raum. Dies führt dazu, dass die Moleküle im festen Zustand (Eis) ein deutlich größeres Volumen einnehmen als im flüssigen Zustand. Die Dichte nimmt beim Erstarren entsprechend sprunghaft ab. Dieses sprunghafte Ansteigen des Volumens beim Erstarren ist ebenfalls eine Besonderheit von Wasser, die durch die Dichteanomalie hervorgerufen wird!
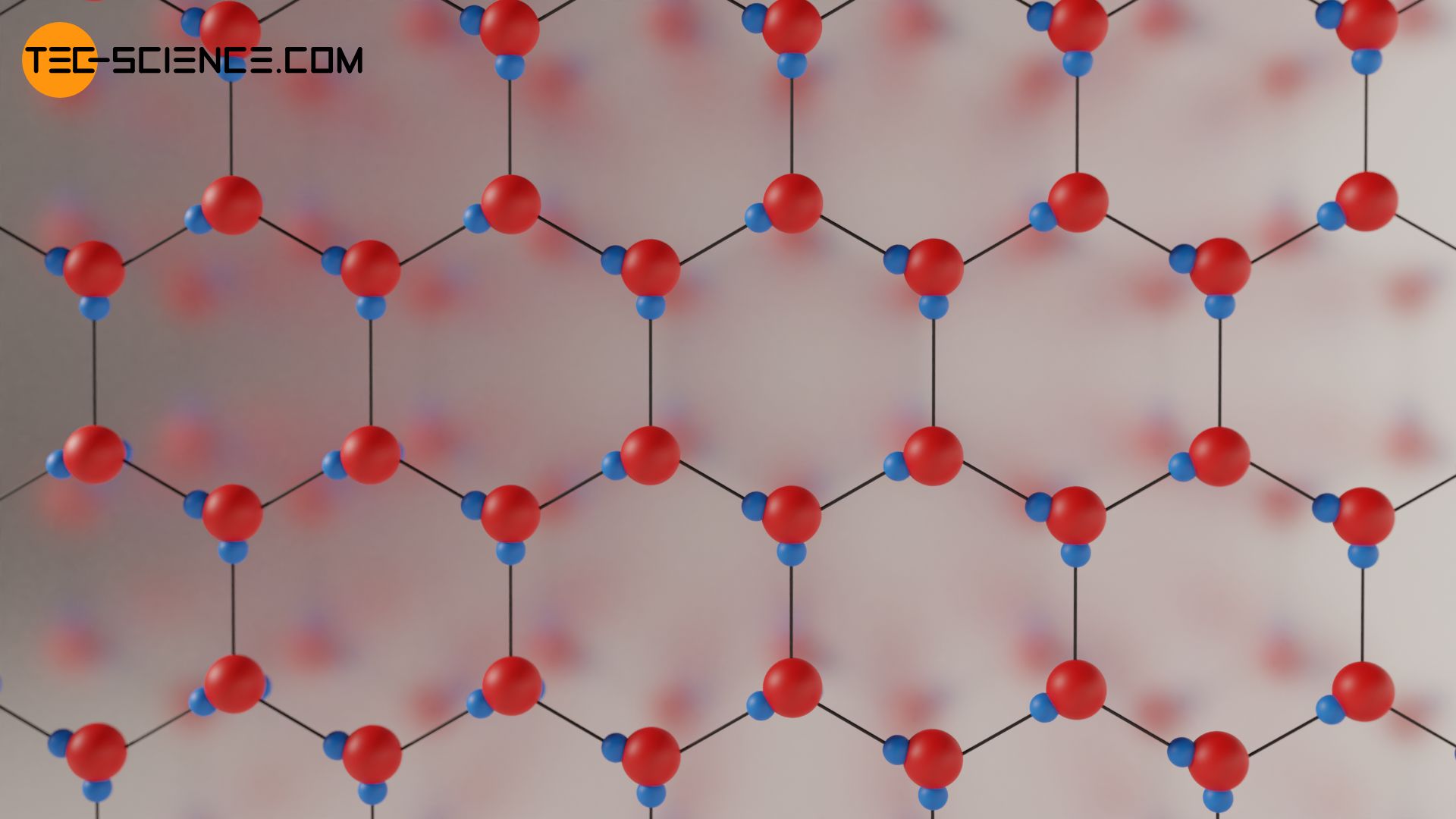
Während flüssiges Wasser bei 0°C eine Dichte von 1,000 g/cm³ aufweist liegt die Dichte bei derselben Temperatur im festen Zustand bei nur 0,917 g/cm³. Das Volumen des Wasser nimmt beim Gefrieren folglich um rund 9 % zu. Getränkeflaschen sollte deshalb niemals randvoll gefüllt werden, wenn diese ins Eisfach zum Gefrieren gelegt werden. Aufgrund der starken Ausdehnung während des Gefrierens würde die Flasche sonst platzen!

Die aufgrund der Volumenvergrößerung wirkenden Kräfte können sogar ganze Felsblöcke zum Brechen bringen, wenn Wasser in vorhandene Risse eindringt und in den Hohlräumen gefriert. Die Volumenzunahme ist auch der Grund dafür, dass im Laufe der Zeit durch gefrorenes Wasser Schlaglöcher im Asphalt entstehen.
Aufgrund der Dichteanomalie ist gefrorenes Wasser bei gleichem Volumen also leichter als flüssiges Wasser. Dies ist letztlich auch der Grund weshalb Eiswürfel in einem Wasserglas ob schwimmen oder Eisberge im Meer zum größten Teil an der Oberfläche treiben.

Da die Dichte von Eis um 8,3 % geringer als die des flüssigen Wassers ist, befindet sich theoretisch auch nur 8,3 % des Eises oberhalb der Wasseroberfläche. Nicht berücksichtigt ist dabei allerdings, dass bspw. Meerwasser aufgrund des darin gelösten Salzes eine höhere Dichte besitzt als Süßwasser. Dies verleiht dem in der Regel aus Süßwasser bestehendem Eisberg zusätzlichen Auftrieb. Ebenfalls muss bedacht werden, dass ein Eisberg normalerweise keine homogene Masse bildet sondern Lufteinschlüsse oder Ähnliches beinhaltet. Dies führt dazu dass Eisberge weniger stark im umgebenden Wasser einsinken wird als theoretisch berechnet. Es ist davon auszugehen, dass sich unter diesen Berücksichtigungen dennoch nicht mehr als etwa 10 bis 20% des Eisberges oberhalb der Wasseroberfläche befinden.