Im Teilchenmodell stellt man sich die Materie aus einzelnen Teilchen (Atome, Moleküle) aufgebaut vor!
Das Teilchenmodell
Zentrales Modell zur Beschreibung von thermodynamischen Vorgängen ist das Teilchenmodell, das im Folgenden näher vorgestellt werden soll. Dabei soll das Teilchenmodell ausschließlich vor dem Hintergrund der Thermodynamik erläutert werden.
Wie im Artikel Aufbau der Stoffe ausführlich beschrieben, bestehen Stoffe aus einzelnen Atomen oder ganzen Atomgruppen (auch Moleküle genannt). Im Allgemeinen bezeichnet man solche atomare Einheiten auch als Teilchen. So wird zum Beispiel nicht nur ein einzelnes Sauerstoffatom O als Teilchen bezeichnet sondern auch molekularer Wasserstoff (H2), welcher sich aus insgesamt zwei Wasserstoffatomen zusammensetzt. Auch größere Moleküle wie bspw. das Wassermolekül H2O wird im Teilchenmodell als ein einziges Teilchen betrachtet, welches sich wiederum aus einzelnen Teilchen zusammensetzt, nämlich aus zwei Wasserstoffteilchen und einem Sauerstoffteilchen.

Man stellt sich die Materie also aus unzählig vielen Teilchen aufgebaut vor. Diese Vorstellung über den Aufbau der Materie bezeichnet man dann als Teilchenmodell.
Im Teilchenmodell stellt man sich die Materie aus einzelnen Teilchen (Atome, Moleküle) aufgebaut vor!
Aggregatzustände
Mit Hilfe des Teilchenmodells kann anschaulich erklärt werden, weshalb sich ein Körper je nach Temperatur unterschiedlich verhält bzw. seine atomare Struktur ändert. Je nachdem wie stark oder schwach die Bindungskräfte zwischen den einzelnen Teilchen eines Stoffes sind, ergeben sich auf atomarer Ebene klassischerweise drei unterschiedliche atomare Strukturen, die sogenannten Aggregatzustände:
- fest,
- flüssig und
- gasförmig.
Als Aggregatzustand bezeichnet man die grundsätzliche atomare Struktur von Stoffen aufgrund ihrere Bindungskräfte. Unterschieden werden klassischerweise der feste, flüssige und der gasförmige Aggregatzustand!
In den nachfolgenden Abschnitten werden diese Aggregatzustände vor dem Hintergrund des Teilchenmodells näher erläutert.
Feststoffe
In Feststoffen sind die Teilchen eines Stoffes aufgrund der relativ großen Bindungskräfte einen bestimmten Ort gebunden. Die Teilchen können je nach Temperatur zwar mehr oder weniger stark schwingen, behalten aber prinzipiell ihre Position innerhalb des Stoffes bei. Würde man die einzelnen Teilchen zum Beispiel in Gedanken nummerieren, so wäre die Nummerierung auch nach einiger Zeit noch dieselbe, da die Teilchen sich nicht frei bewegen können.

Die zwischen den einzelnen Molekülen oder Atomen wirkenden Bindungskräfte bezeichnet man auch als intermolekulare bzw. interatomare Bindungskräfte (symbolisiert durch die „Stäbe“ zwischen den Teilchen in der oberen Abbildung). Diese starken interatomaren Bindungskräfte sorgen in Feststoffen letztlich dafür, dass der Stoff – auch unter Einwirkung moderater äußerer Kräfte – seine Form beibehält und nicht ohne weiteres auseinander fällt.
In Feststoffen sind die Teilchen aufgrund der großen Bindungskräfte einen festen Ort gebunden. Hierdurch behält der Festkörper seine Form stabil bei!
Flüssigkeiten
In Flüssigkeiten hingegen wirken im Vergleich zu Feststoffen geringere intermolekulare Bindungskräfte, sodass die Teilchen nicht mehr an einen festen Platz gebunden sind. Die Teilchen können sich innerhalb der relativ schwach wirkenden Bindungskräfte frei bewegen und ihren Ort wechseln. Würde man die Teilchen in Gedanken nummerieren, so wäre bereits nach kurzer Zeit diese Nummerierung durcheinander.

Die relativ schwachen Bindungskräfte sind auch der Grund weshalb Flüssigkeiten keine feste Form besitzen. Bereits durch die eigene Schwerkraft der Teilchen können die intermolekularen Bindungskräfte nicht mehr die Form des Stoffes aufrecht halten – der Stoff zerfließt.
In Flüssigkeiten sind die Teilchen aufgrund der geringeren Bindungskräfte nicht mehr an einen festen Ort gebunden. Der Stoff kann durch die geringen Bindungskräfte zwar noch zusammengehalten werden, besitzt aber aufgrund der sich frei bewegenden Teilchen keine feste Form.
Gase
In Gasen sind die intermolekularen Kräfte nochmals deutlich geringer als in Flüssigkeiten. Die einzelnen Teilchen verspüren untereinander also fast keine Bindungskräfte mehr. Sie können sich deshalb, anders als in Flüssigkeiten, relativ frei im Raum verteilen. Dies ist auch der Grund weshalb sich ausströmendes Gas einer Gasflasche rasch im ganzen Raum verteilt.

In Gasen sind die Bindungskräfte so gering, dass sich die Teilchen frei im Raum bewegen und nicht mehr zusammengehalten werden können.
In einer idealisierten Modellvorstellung von Gasen wird sogar davon ausgegangen, dass die Teilchen keinerlei Bindungskräfte untereinander ausüben und als Massepunkte anzunehmen sind, d.h. sie werden als Teilchen ohne räumliche Ausdehnung betrachtet. Eine weitere Annahme ist, dass zwischen den Teilchen selbst oder zwischen Teilchen und Gefäßwand nur ideal elastische Stöße auftreten. Mithilfe dieser idealisierten Vorstellung eines sogenannten idealen Gases lassen sich viele thermodynamische Prozesse von realen Gasen in sehr guter Näherung beschreiben.
Für die Teilchen eines idealen Gases werden folgenden Annahmen zugrunde gelegt:
• sind als Massenpunkte anzunehmen,
• besitzen keinerlei Bindungskräfte untereinander und führen
• nur elastische Stöße aus.
Aggregatzustandsänderungen
Je nach Änderung des Aggregatzustandes eines Stoffes von fest zu flüssig, von flüssig zu gasförmig oder von fest zu gasförmig (bzw. umgekehrt) existieren unterschiedliche Bezeichnungen. Solche Aggregatzustandsänderungen werden auch als Phasenübergänge bezeichnet.
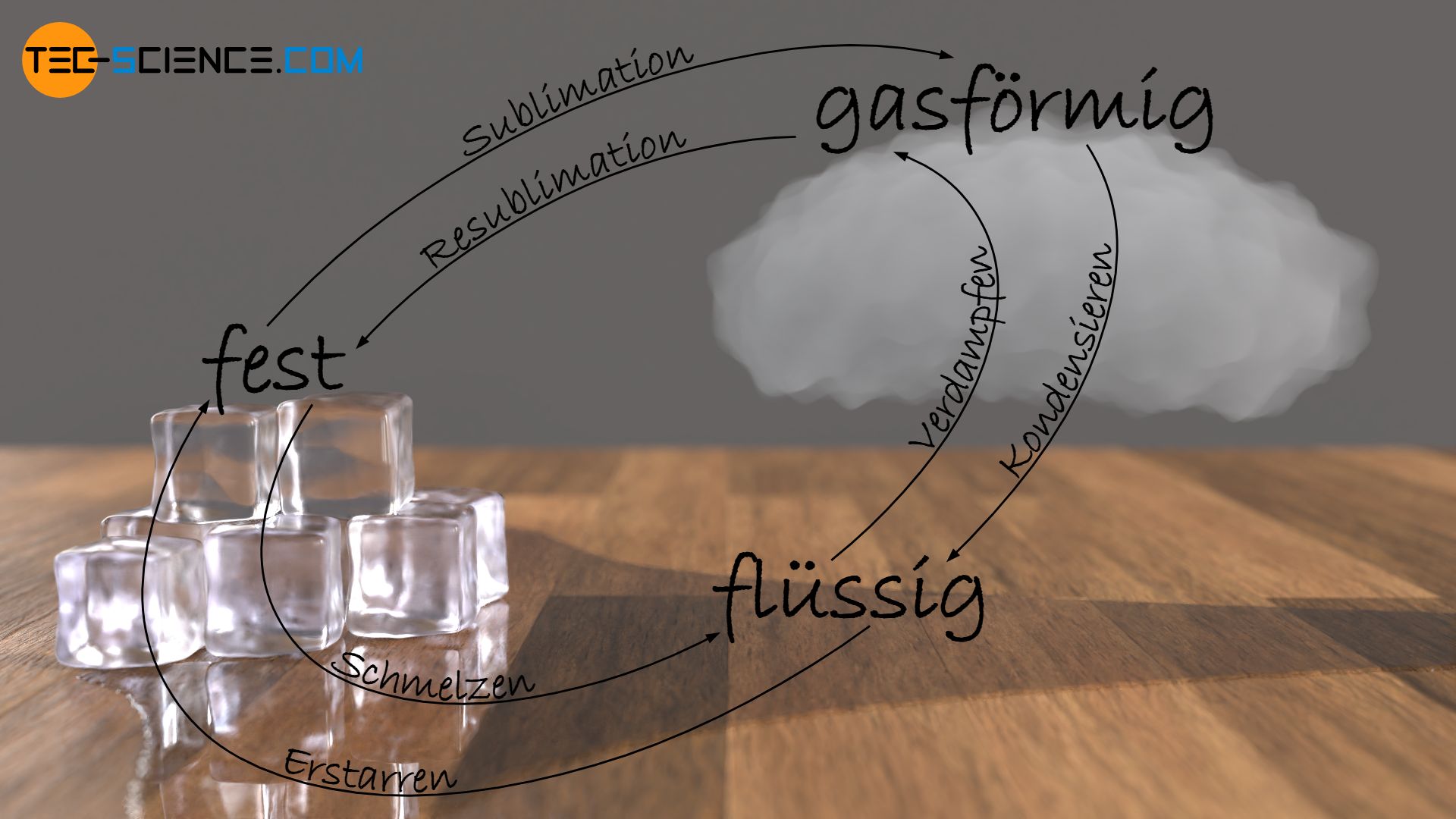
So wird die Zustandsänderung von fest zu flüssig als Schmelzen bezeichnet. Den umgekehrten Prozess als Erstarren („gefrieren“).
Als Verdampfen bezeichnet man den Phasenübergang von flüssig zu gasförmig, den umgekehrten Prozess als Kondensieren.
Schließlich existiert noch eine weitere Zustandsänderung, die direkt vom festen in den gasförmigen Zustand führt. Dieser Prozess wird Sublimation genannt; den umgekehrten Vorgang vom gasförmigen direkt in den festen Zustand bezeichnet man als Resublimation. Sublimationsvorgänge kennt man bspw. von sogenanntem Trockeneis (festes Kohlenstoffdioxid CO2), welches bei rund -80°C direkt vom festen Zustand in den gasförmigen übergeht, ohne dabei zu verflüssigen.

Erklärung der Phasenübergänge mithilfe des Teilchenmodells
Mit dem Teilchenmodell lassen sich die Aggregatzustandsänderungen wie Schmelzen oder Verdampfen anschaulich erläutern. Wird die Temperatur eines Feststoffes allmählich erhöht, so bewegen sich die zunächst relativ stark aneinander gebundenen Teilchen immer heftiger. Sind die Schwingung schließlich so heftig geworden, dass die Teilchen einen relativ großen Abstand zueinander gewinnen, so lassen die intermolekularen Bindungskräfte in ihrer Stärke nach. Die Stoffteilchen sind nun nicht mehr an ihren festen Platz gebunden. Der feste Stoff beginnt schließlich flüssig zu werden, er schmilzt.
Wird der nun flüssige Stoff weiter erwärmt, so werden die Bindungskräfte durch die stärker werdenden Teilchenbewegungen mehr und mehr „gelockert“. Ab einer bestimmten Grenze haben die intermolekularen Bindungskräfte schließlich so weit abgenommen, dass die Teilchen sich (fast) frei bewegen können. Die Bewegungsenergie der Teilchen ist größer als die Bindungsenergie, die die Teilchen normalerweise aneinander bindet. Die Teilchen können sich salopp formuliert von den Bindungskräften „losreißen“. Die Flüssigkeit ist nun gasförmig geworden.
Veranschaulichung der Phasenübergänge
Die Aggregatzustandsänderungen kann man sich mit Hilfe von Magneten veranschaulicht vorstellen. Dabei stehen die Magnete für die Stoffteilchen und die zwischen ihnen wirkenden magnetischen Kräfte für die intermolekularen Bindungskräfte. Werden nun viele Magnete zusammengenommen, so bilden diese eine relativ stabile Struktur, die der eines Festkörpers gleicht.
Wird dieses Magnetgebilde nun relativ stark in Schwingung versetzt, so wird man einige Magnete dabei beobachten können, wie sie sich aufgrund der Trägheit den magnetischen Anziehungskräften kurzzeitig widersetzen und sich voneinander lösen können. Anschließend werden sie allerdings von den magnetischen Kräften wieder „eingefangen“. Die Magnete können sich bei starken Schwingungen also voneinander lösen und sind damit nicht mehr an einen bestimmten Platz gebunden. Das Magnetgebilde wird zwar durch die immer noch vorhandenen Anziehungskräfte weiterhin in sich bestehen bleiben, allerdings wird es allmählich seine Form verlieren, so wie dies ein Festkörper beim Schmelzen tun wird. Das „Lockern“ der magnetischen Anziehungskräfte durch heftige Schwingungen käme also dem Schmelzprozess gleich.
Werden die Magnete schließlich noch heftiger bewegt, so können einzelne Magnete auch regelrecht davonfliegen. Gegen die hohe Fluchtgeschwindigkeit der Magnete können auch die magnetischen Kräfte schließlich nichts mehr ausrichten. Selbst wenn zwei oder mehr Magnete direkt aufeinander prallen, wird die Wucht so groß sein, dass diese sofort wieder auseinanderfliegen. Das Magnetgebilde wird sich bei zu heftigen Schwingungen also allmählich „auflösen“, da die Anziehungskräfte den heftigen Schwingungen nicht mehr standhalten können. Dieser Vorgang käme dem Verdampfungsprozess einer Flüssigkeit gleich, deren Teilchen so stark in Schwingung versetzt werden, dass diese den intermolekularen Anziehungskräften entkommen können.
Beim Sublimationsprozess hingegen werden die Bindungen so rasch gelockert, dass der Feststoff direkt in den gasförmigen Zustand übergeht.