Im Hochofen reagiert das Eisenerz mit dem im Koks enthaltenen Kohlenstoff, sowie mit Zuschlägen, sodass sich graues oder weißes Roheisen bildet.
Verbrennungsvorgang
Das in oxidierter Form gebundene Eisen in den aufbereiteten Erzen muss durch chemische Prozesse herausgelöst werden. Hierfür wird ein Stoff benötigt, der den Sauerstoff stärker an sich bindet als das Eisen selbst. Genau dies kann Kohlenstoff als Reduktionsmittel leisten. Der Kohlenstoff wird dabei in Form von Koks (pyrolysierte Kohle) aus der Kokerei dem Hochofen zugeführt.
Bei ausreichend hohen Temperaturen kann der Kohlenstoff dabei direkt an der Reduktion des Eisens teilnehmen (direkte Reduktion). Bei geringeren Temperaturen erfolgt die Reduktion indirekt mit Hilfe des bei der Verbrennung gebildeten Kohlenstoffmonoxidgases (indirekte Reduktion). In beiden Fällen wird das Eisenoxid zu Eisen reduziert.
Der Einsatz von Kohlenstoff als Reduktionsmittel ist nicht nur der großen Verfügbarkeit geschuldet sondern als gasförmiger Stoff hat Kohlenmonoxid den Vorteil, dass es in die porösen Erze gut eindringen und mit den darin enthaltenen Eisenoxiden reagieren kann. Aus diesem Grund werden die Eisenerze auch in Form von Sinter und Pellets so porös wie möglich aufbereitet.
Kohlenstoff liefert nicht nur die notwendige Wärme zum Schmelzen des Eisenerzes sondern dient in besonderer Weise als Reduktionsmittel, um die Eisenoxide zu Eisen zu reduzieren!
Auf die einzelnen chemischen Vorgänge im Hochofen wird in den folgenden Abschnitten näher eingegangen.
Um die nötige Wärme und das Reduktionsgas Kohlenstoffmonoxid (\(CO\)) zu erzeugen, wird im unteren Teil des Hochofens das Koks unter Zufuhr des eingeblasenen Heißwindes verbrannt. Der im Koks enthaltene Kohlenstoff (\(C\)) reagiert mit dem Luftsauerstoff im Heißwind (\(O_2\)) zunächst nach folgender Reaktionsgleichung zu Kohlendioxid (\(CO_2\)):
\begin{align}
\label{kohlendioxid}
& C + O_2 \rightarrow CO_2 ~~~ \text{(exotherm)} \\[5px]
\end{align}
Die Verbrennung ist sehr stark exotherm, d.h. es wird – wie bei einem Verbrennungsvorgang üblich – Wärme frei. Dies führt zu einem Temperaturanstieg von bis zu 2000 °C. Das entstandene Kohlendioxidgas (\(CO_2\)) reagiert aufgrund der sehr hohen Temperaturen wieder mit dem im Koks enthaltenen Kohlenstoff (\(C\)) und bildet das reduktionsfähige Kohlenmonoxidgas (\(CO\)).
\begin{align}
\label{kohlenmonoxid}
& CO_2 + C \rightleftharpoons 2~CO ~~~ \text{(endotherm)} \\[5px]
\end{align}
Die Bildung von Kohlenmonoxid erfolgt endotherm, d.h. unter Energieaufnahme, sodass die Temperatur des Gases auf etwa 1700 °C fällt. Ein zu starker Temperaturabfall muss allerdings unbedingt vermieden werden, da die Reaktion von Kohlendioxid zu Kohlenmonoxid nur bei ausreichend hohen Temperaturen abläuft.
Eine zu geringe Temperatur würde wieder die Rückreaktion (angedeutet durch den Doppelpfeil in der Reaktionsgleichung) des reduktionsfähigen Kohlenmonoxidgases zu Kohlendioxid bedeuten. Aber genau dieses Kohlenmonoxid ist für die Reduktion der Eisenoxide notwendig und muss in ausreichendem Maße gebildet werden.
Boudouard-Gleichgewicht
Die Reaktion von Kohlendioxid und Kohlenstoff zu Kohlenmonoxid sowie deren Rückreaktion ist temperaturabhängig und wird durch das sogenannte Boudouard-Gleichgewicht beschrieben.
Die Situation kann man sich mit dem Verdunsten von Wasser in einem geschlossenen, mit Luft gefüllten Raum veranschaulichen. Die Luft vermag je nach Temperatur eine bestimmte Menge Wasser aufzunehmen. Ist die Luft vollständig mit Wasser gesättigt, so kann diese keine weitere Wassermengen aufnehmen und es verbleibt ein Rest an flüssigem Wasser im Raum. Es wird sich mit der Zeit also ein Gleichgewicht zwischen dem noch flüssigen Wasser und dem in der Luft enthalten Wasser einstellen.
Während durch statistische Schwankungen zwar an einer lokalen Stelle das flüssige Wasser kurzzeitig verdunsten kann („Hinreaktion“), so wird an anderer Stelle allerdings wieder Wasser lokal aus der übersättigten Luft kondensieren („Rückreaktion“). Global betrachtet wird sich jedoch ein Gleichgewicht zwischen diesen Phasen bzw. zwischen der Hin- und Rückreaktion von flüssigem und in Luft gebundenem Wasser einstellen. Man spricht deshalb auch von einem dynamischen Gleichgewicht.
Dieses dynamische Gleichgewicht kann jedoch je nach Temperatur zu Gunsten oder zu Lasten des flüssigen Wassers verschoben werden. Bei hohen Temperaturen kann die Luft mehr Wasser aufnehmen, sodass auch mehr Wasser verdunsten wird und der noch flüssige Anteil sinkt. Das Gleichgewicht verschiebt sich somit in Richtung des Verdunstungsprozess. Wird die Temperatur hingegen gesenkt, so kondensiert ein Teil des in Luft gebundenen Wassers aus und der flüssige Anteil am Boden steigt. Das Gleichgewicht verschiebt sich dann in Richtung des Kondensationsprozesses (dieser Effekt ist auch sehr anschaulich an gekühlten Getränkedosen zu beobachten, an denen das in der Luft enthaltene Wasser kondensiert und sich Wasserperlen bilden).
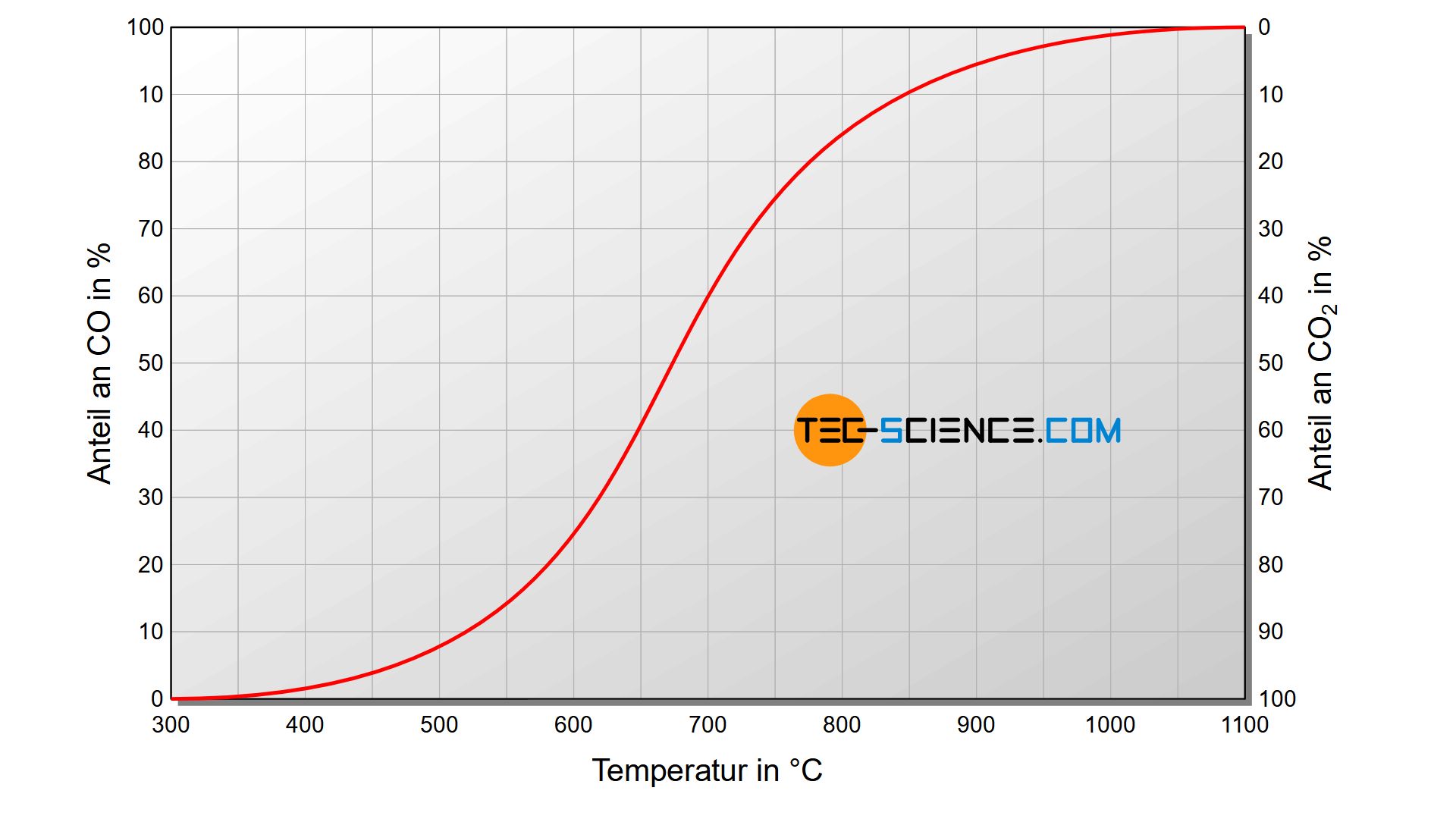
Auf die analoge Weise existiert auch ein temperaturabhängiges Gleichgewicht zwischen der oben genannten Reaktion von Kohlenstoffdioxid zu Kohlenstoffmonoxid und der entsprechenden Rückreaktion von Kohlenmonoxid zu Kohlendioxid. Die Abbildung oben zeigt das Verhältnis der Gleichgewichtszustände zwischen Kohlenmonoxid und Kohlendioxid. Es wird offensichtlich, dass bei Temperaturen oberhalb 1000 °C das Kohlendioxid fast ausschließlich zu Gunsten des Kohlenmonoxids zerfällt.
Bei hohen Temperaturen reagiert Kohlenstoff mit Kohlenstoffdioxid überwiegend zu (reduktionsfähigem) Kohlenstoffmonoxid. Bei geringen Temperaturen zerfällt das gebildete Kohlenstoffmonoxid überwiegend zu Kohlenstoffdioxid und Kohlenstoff!
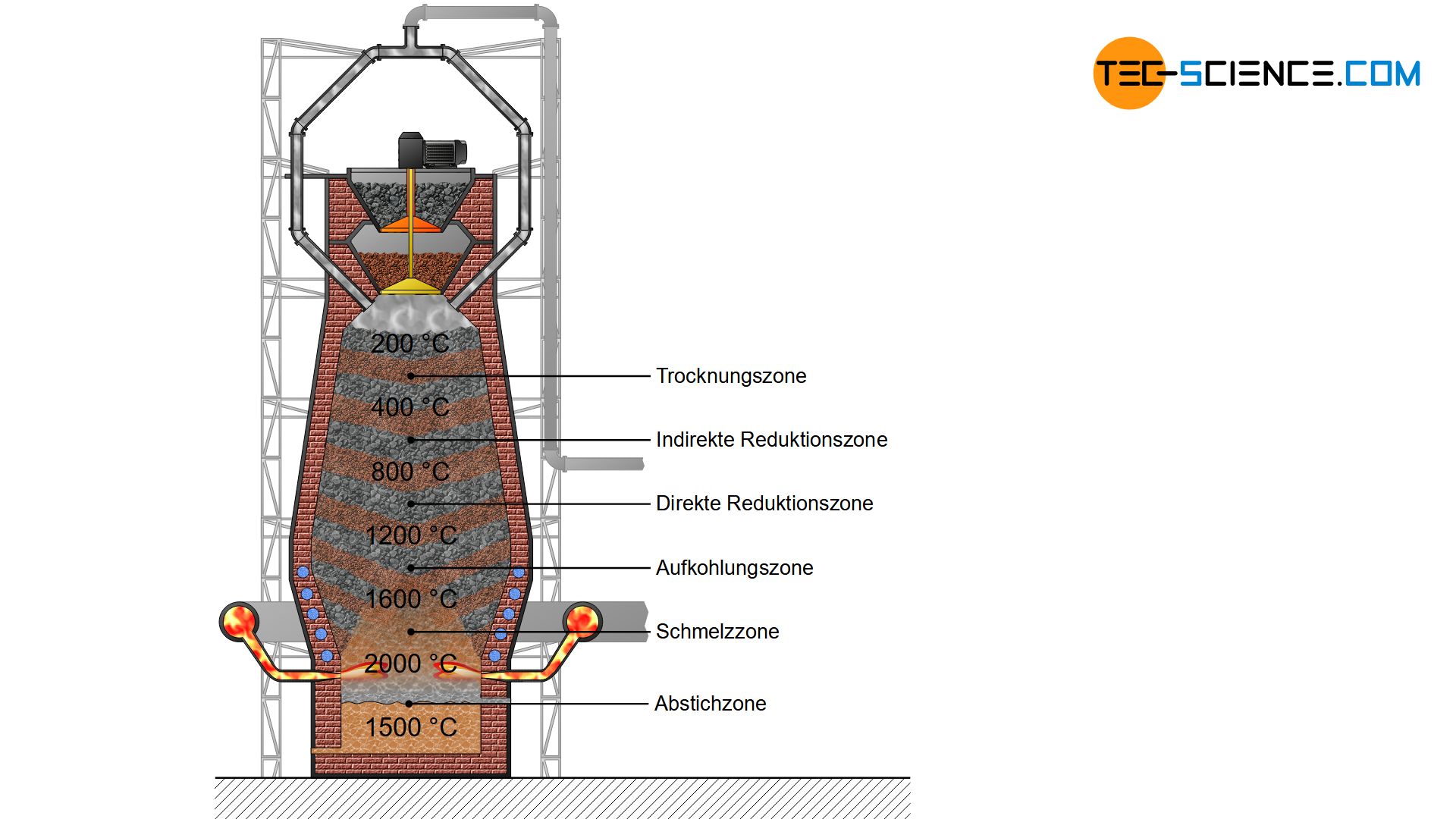
Trocknungszone
Durch die Verbrennung des Kokses bilden sich heiße Gase, die hauptsächlich aus Kohlenmonoxid, Kohlendioxid, Stickstoff und (gasförmigem) Wasser bestehen. Diese heißen Gase steigen im Hochofen nach oben und kühlen sich ab. Von maximal 2000 °C auf Höhe der Windformen nimmt die Temperatur bis zur Gicht hin auf rund 200 °C ab. Bei dieser Temperatur wird der eingefüllte Möller und das Koks zunächst getrocknet und vorgewärmt. Diese Zone des Hochofens wird deshalb als Trockungszone bezeichnet.
In der Trockungszone wird der Möller und das Koks vorgewärmt und getrocknet!
Indirekte Reduktionszone
Ein weiteres Absenken der Eisenerze im Hochofen führt in die Temperaturzone von 400 °C bis 800 °C. In diesem Bereich findet die sogenannte indirekte Reduktion der Erze zu Eisen durch das Kohlenmonoxid statt.
Das Kohlenmonoxidgas (\(CO\)) wird durch Aufnahme des im Eisenoxid enthaltenen Sauerstoffs (\(O\)) dabei zu Kohlendioxid (\(CO_2\)) oxidiert. Die indirekte Reduktion kann in mehrere Zwischenreaktionen gegliedert werden, wobei der Eisengehalt in den Erzen stetig zunimmt und letztlich reines Eisen entsteht.
Zunächst wird das schwach eisenhaltige Hämatit (\(Fe_2O_3\)) durch das Kohlenmonoxid (\(CO\)) zu eisenhaltigerem Magnetit (\(Fe_3O_4\)) reduziert. Anschließend folgt die Reduktion des Magnetits zu sogenanntem Wüstit (\(FeO\)), bevor dieser abschließend zu Eisen (\(Fe\)) reduziert wird:
\begin{align}
\label{indirekt}
3~Fe_2O_3 &~+~ CO &&\rightarrow~ 2~Fe_3O_4 &&+ ~CO_2 ~~~~~~ \text{(Hämatit} \rightarrow \text{Magnetit)} \\[5px]
Fe_3O_4 &~+~ CO &&\rightarrow~ 3~FeO &&+ ~CO_2 ~~~~~~ \text{(Magnetit} \rightarrow \text{Wüstit)} \\[5px]
FeO &~+~ CO &&\rightarrow~ Fe &&+ ~CO_2 ~~~~~~ \text{(Wüstit} \rightarrow \text{Eisen)} \\[5px]
\end{align}
Lediglich die letzte Reaktion von Wüstit zu Eisen ist exotherm und liefert Wärme. Die freiwerdende Wärme reicht jedoch als Wärmelieferant für ersten beiden endothermen Reaktionen aus. Die Gesamtbilanz bleibt somit exotherm. Dennoch ist die Temperatur in dieser indirekten Reduktionszone mit 400 °C bis maximal 800 °C zu gering, um das reduzierte Eisen zu schmelzen! Die Konsistenz des Eisens ist deshalb nach wie vor fest.
In den ungeschmolzenen Eisenerzen befinden sich immer noch nicht-reduzierte Eisenoxide. Auch eine ungünstige Aufhäufung der Erze kann an den Kontaktstellen eine Gasdurchströmung erschweren und somit nicht-reduziertes Eisenerz zurücklassen. Spätestens wenn jedoch in den tieferen und heißeren Schichten der Schmelzvorgang eintritt, kann eine nahezu vollständige Reduzierung der Eisenerze erfolgen.
In der indirekten Reduktionszone wird das in den Eisenerzen enthaltene Eisenoxid durch Kohlenmonoxidgas reduziert, wobei die Eisenerze selbst nicht aufgeschmolzen werden!
Direkte Reduktionszone
Wandern die noch nicht reduzierten Eisenerze im Hochofen weiter nach unten, dann kann der Kohlenstoff aufgrund der hohen Temperaturen auch direkt die im Erz enthaltenen Eisenoxide reduzieren. Der Kohlenstoff (\(C\)) wird durch die Aufnahme des Sauerstoffs (\(O\)) dabei zu Kohlenstoffmonoxid (\(CO\)) oxidiert. Aufgrund der direkten Reduktion der Eisenoxide durch den Kohlenstoff, spricht man auch von einer direkten Reduktion.
Die Direktreduktion läuft in der Temperaturzone zwischen ca. 800 °C bis etwa 1600 °C ab. Die direkte Reduktion kann wieder in Zwischenschritte unterteilt werden, bei denen der Eisengehalt in den Erzen jeweils zunimmt:
\begin{align}
\label{direkt}
3 Fe_2O_3 &~+~ C &&\rightarrow~ 2~Fe_3O_4 &&+ ~CO ~~~~~~ \text{(Hämatit} \rightarrow \text{Magnetit)} \\[5px]
Fe_3O_4 &~+~ C &&\rightarrow~ 3~FeO &&+ ~CO ~~~~~~ \text{(Magnetit} \rightarrow \text{Wüstit)} \\[5px]
FeO &~+~ C &&\rightarrow~ Fe &&+ ~CO ~~~~~~ \text{(Wüstit} \rightarrow \text{Eisen)} \\[5px]
\end{align}
Diese Reaktionen sind allesamt endotherm. Die hierfür benötigte Wärme wird durch die (exotherme) Verbrennung des Kokses bereitgestellt. Auch die in der Gangart enthaltenen Silizium-, Mangan und Phosphorverbindungen (sowie viele weitere Verbindungen) werden in diesem Zusammenhang endotherm reduziert. Die hierfür notwendige Wärme muss zusätzlich durch die Kohlenstoffverbrennung erzeugt werden. Um den Wärmeeinsatz aus energetischen Gründen so gering wie nötig zu halten, sollten den Erzen deshalb so wenig Gangart wie möglich beigemengt sein. Dies macht die bereits erläuterte Erzaufbereitung notwendig.
Die reduzierten Beimengungen im Hochofen reagieren anschließend mit den zugesetzten Zuschlägen im Möller und werden in der hieraus entstehenden Schlacke gebunden.
In der direkten Reduktionszone nimmt der Kohlenstoff direkt an der Reduktion der Eisenoxide teil!
Aufkohlungszone
Der Kohlenstoff reduziert zwar die Eisenoxide und lässt Eisen entstehen, jedoch reichert sich das gebildete Eisen teilweise selbst mit Kohlenstoff an. Dies geschieht entweder durch das Kohlenmonoxidgas oder bei höheren Temperaturen auch direkt durch den Kohlenstoff. Es entsteht dabei die Eisencarbidverbindung \(Fe_3C\), die auch Zementit genannt wird.
Das Anreichern des festen Eisens mit Kohlenstoff in einem Temperaturbereich zwischen 900 °C und 1200 °C wird auch als Aufkohlung bezeichnet. Die entsprechenden chemischen Reaktionen hierfür lauten wie folgt:
\begin{align}
\label{aufkohlen}
3 Fe &~+~ 2 CO &&\rightarrow~ Fe_3C ~+~CO_2 \\[5px]
3 Fe &~+~ C &&\rightarrow~ Fe_3C \\[5px]
\end{align}
Durch die Aufnahme des Kohlenstoffs wird der Schmelzpunkt des Eisens von 1536 °C bis auf ca. 1200 °C gesenkt (siehe Eisen-Kohlenstoff-Diagramm).
In der Aufkohlungszone reichert sich das reduzierte Eisen mit Kohlenstoff an und bildet die intermediäre Verbindung Eisencarbid (\(Fe_3C\), Zementit)! Durch die Aufkohlung senkt sich die Schmelztemperatur des Eisens!
Schmelzzone
Aufgrund der Erniedrigung des Schmelzpunktes durch eindiffundierten Kohlenstoff in das reduzierte Eisen fängt dieses in den heißeren Hochofenschichten an zu schmelzen. Nun kommen auch die innenliegenden Erzschichten mit dem Kohlenstoff bzw. dem Kohlenmonoxid in Kontakt und können zu Eisen reduziert und anschließend aufgekohlt werden. Allmählich wird somit das gesamte Eisenerz reduziert, aufgekohlt und geschmolzen. Der aufgenommene Kohlenstoff bleibt dabei in der flüssigen Eisenschmelze gelöst. Dies ist der Grund weshalb Roheisen einen relativ hohen Kohlenstoffanteil aufweist.
In der Schmelzzone beginnt das Eisen zu schmelzen und bildet stark kohlenstoffhaltiges Roheisen!
Abstichzone
Das flüssige Roheisen sammelt sich schließlich zusammen mit der ebenfalls flüssigen Schlacke im Gestell des Hochofens. Aufgrund der höheren Dichte des Roheisens kann das Roheisen am tiefsten Punkt des Hochofens abgestochen werden (Abstich genannt). Es weist mit etwa 4,5 % einen hohen Kohlenstoffgehalt auf. Weitere Begleitelemente sind nachfolgend aufgelistet, wobei die Zusammensetzung je nach Roheisensorte zum Teil erheblich abweicht.
- 4,5 % Kohlenstoff
- 2,5 % Silizium
- 1,5 % Mangan
- 0,5 % Phosphor
- 0,1 % Schwefel
Weitere Elemente wie Titan, Kupfer, etc. sind ebenfalls in geringen Mengen im Roheisen enthalten.
Vor allem der Siliziumgehalt entscheidet bei einer Erstarrung des flüssigen Roheisens darüber, ob sich der gelöste Kohlenstoff dabei in Reinform als Graphit (\(C\)) im Gefüge ausscheidet oder als Eisencarbidverbindung Zementit (\(Fe_3C\)).
Bei hohen Siliziumkonzentrationen wird die Graphitausscheidung bevorzugt. Die Graphitbildung wird auch durch einen relativ niedrigen Mangangehalt und langsamer Abkühlung begünstigt. Bei einem relativ niedrigen Siliziumgehalt wird hingegen die Zementitausscheidung bei einer Erstarrung des Roheisens bevorzugt. Diese wird wiederum durch relativ hohe Mangankonzentrationen und schnellere Abkühlgeschwindigkeiten begünstigt.
Da bei hohen Temperaturen und langen Glühzeiten der gebildete Zementit wieder in seine Bestandteile (Eisen und Kohlenstoff) zerfallen würde, bezeichnet man diese Erstarrungsform im thermodynamischen Sinne auch als metastabile Erstarrung. Im Gegensatz hierzu handelt es sich bei Graphit um eine thermodynamisch stabile Verbindung, die auch bei noch so langen Glühzeiten bestand hat. Deshalb bezeichnet man diese Erstarrungsform auch als stabile Erstarrung.
Durch den Graphit im stabil erstarrten Gefüge erscheint die Bruchfläche des Roheisens matt-grau. Deshalb wird das stabil erstarrte Roheisen auch als graues Roheisen bezeichnet. Die Bruchfläche einer metastabil erstarrten Roheisensorte wirkt hingegen eher weißlich-glänzend und wird deshalb auch weißes Roheisen genannt.

Bei einer stabilen Erstarrung scheidet sich der Kohlenstoff in Reinform als Graphit aus dem Gefüge aus (graues Roheisen)! Bei der metastabilen Erstarrung wird die Eisencarbidverbindung Zementit gebildet (weißes Roheisen)!
Das graue Roheisen („Gußroheisen“) dient als Rohstoff für Gießereien, um hieraus verschiedene Gußeisensorten bzw. Gußeisenwerkstoffe zu produzieren. Es wird meistens in kleinen Barren, den sogenannten Masseln, vergossen und den Gießereien zum Einschmelzen mit anderen Stoffen angeboten (Gattierung). Die Nachfrage an grauem Roheisen macht jedoch nur ein geringer Teil der Gesamtnachfrage aus. Mehr als 90 % des Roheisens wird nämlich als weißes Roheisen („Stahlroheisen“) abgestochen und in flüssiger Form im Stahlwerk durch spezielle Nachbehandlungsverfahren zum eigentlichen Stahl verarbeitet. Auf diese Prozesse wird in den folgenden Abschnitten näher eingegangen.