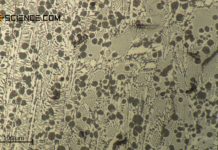
Stähle erstarren als Mischkristalllegierung. Das kubisch-flächenzentrierte Gefüge mit dem darin eingelagerten Kohlenstoffatom wird Austenit genannt.
Einleitung
Bei Stählen handelt es sich im Prinzip um Zweistofflegierungen, bestehend aus dem Hauptelement Eisen und dem Legierungselement Kohlenstoff mit maximal 2 % Anteil (über 2 % Kohlenstoff wird die Eisen-Kohlenstoff-Legierung als Gusseisen bezeichnet!). Dabei sorgt der Kohlenstoff für die nötige Festigkeit und Härte, da Eisen alleine als Konstruktionswerkstoff zu weich wäre. Um Stähle gemäß diesen unterschiedlichen Anforderungen (hohe Härte oder hohe Festigkeit, oder ein Kompromiss aus beiden) gezielt herstellen zu können, ist ein tiefergehendes Verständnis über das Zweistofflegierungssystem Eisen/Kohlenstoff erforderlich.
Stahl ist Legierung aus Eisen und Kohlenstoff, wobei der Kohlenstoffgehalt unter 2 % liegt! Bei einem Kohlenstoffgehalt von über 2 % spricht man von Gusseisen!
Anders als die bisher betrachteten Zweistoffsysteme, findet bei Eisen allerdings nicht nur während der Erstarrung eine Phasenumwandlung statt. Eisen zeigt darüber hinaus eine Polymorphie (Allotropie), d.h. je nach Temperatur existiert Eisen in unterschiedlichen Gittermodifikationen. Diese bedingen im festen Zustand weitere Phasenumwandlungen. Deshalb gestaltet sich das Phasendiagramm des Legierungssystems Eisen/Kohlenstoff etwas komplexer.
Um die Gefügevorgänge im Inneren eines Stahls verstehen zu können, ist es sinnvoll zunächst die Gefügeentstehung von reinem Eisen näher zu betrachten. Aus diesem Grund wird im folgenden Abschnitt die Abkühlkurve von Eisen näher diskutiert.
Gefügeentstehung von Reineisen
Im Folgenden soll das Abkühlverhalten von reinem Eisen näher betrachtet werden. Da Reineisen im erstarrten Zustand relativ weich ist, bezeichnet man dieses auch als Weicheisen.
Die Abkühlkurve von reinem Eisen (Fe) weist eine Reihe von Haltepunkten auf bei denen jeweils unterschiedliche Vorgänge im Gefüge stattfinden. Der erste Haltepunkt findet sich bei der Erstarrungstemperatur von 1536 °C wieder. Dort kristallisiert die Schmelze in einer kubisch-raumzentrierten Gitterstruktur (krz). In diesem Zustand wird das Eisen auch als \(\delta\)-Eisen (\(\delta\)-Fe) bezeichnet. Beachte, dass beim \(\delta\)-Eisen das gesamte Gefüge bereits vollständig erstarrt ist. Somit vollziehen sich alle weiteren Phasenumwandlungen letztlich im bereits erstarrten Zustand!
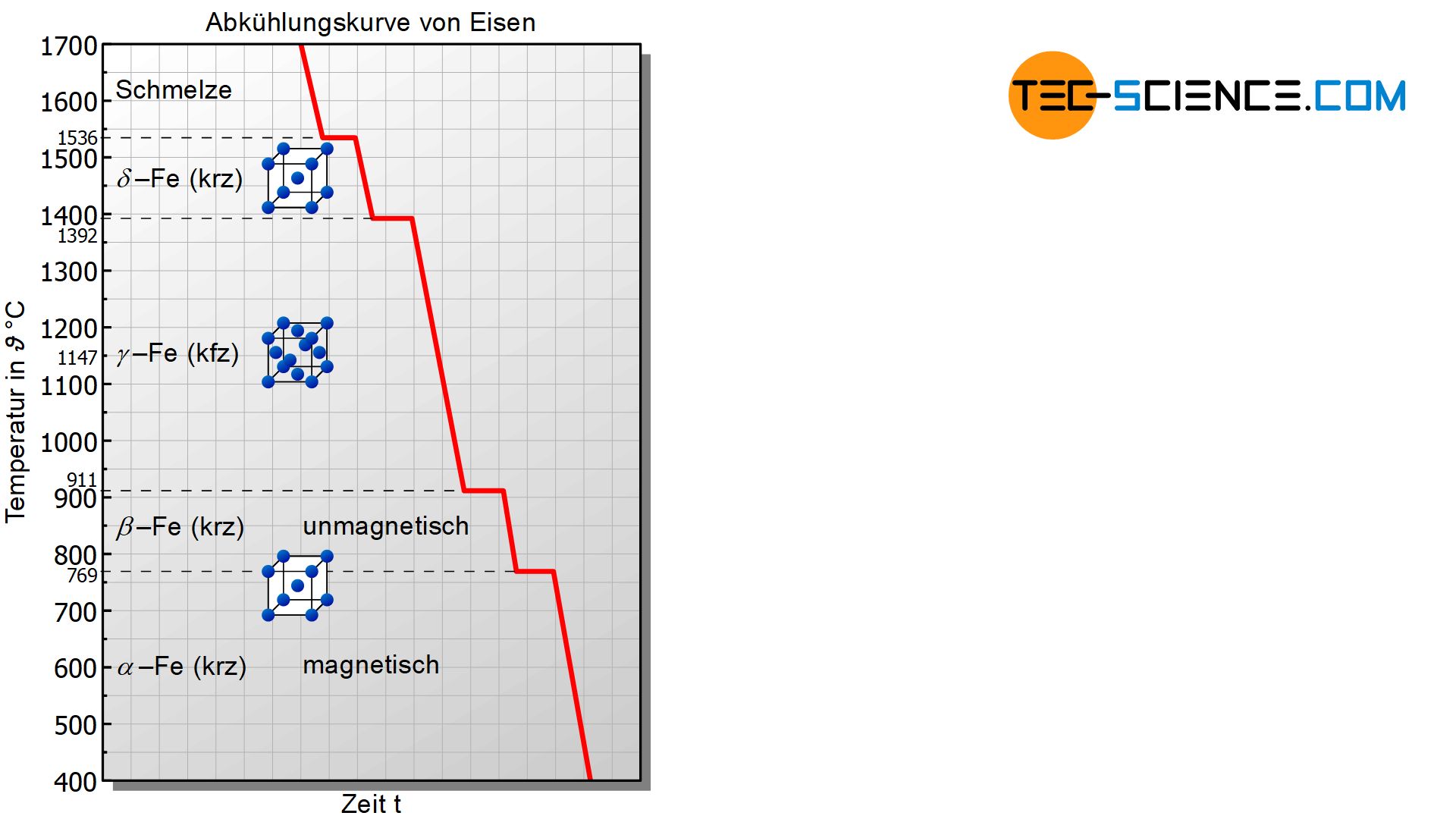
Bei einer Temperatur von 1392 °C wandelt sich das kubisch-raumzentrierte \(\delta\)-Eisen bei konstanter Temperatur in die kubisch-flächenzentrierte Struktur (kfz) um. In dieser Gittermodifikation wird das Eisen auch als \(\gamma\)-Eisen bezeichnet. Da sich bei einer Gitterumwandlung die Atomstruktur und somit die Bindungsenergien ändern ist dies auch mit einem Energieumsatz wie bei einer Aggregatzustandsänderung verbunden. Deshalb ändert sich die Gitterstruktur bei konstanter Temperatur (Haltepunkt)!
Eine nochmalige Gitterumwandlung findet schließlich bei 911 °C statt. Bei dieser Temperatur wandelt sich das kubisch-flächenzentrierte Eisen wieder in die kubisch-raumzentrierte Struktur um. In dieser Form wird das Eisen auch (\beta\)-Eisen genannt.
Ein letzter Haltepunkt tritt schließlich bei einer Temperatur von 769 °C auf. Dieser ist allerdings nicht auf eine Gitterumwandlung zurückzuführen ist! Ursache des Haltepunktes ist ein quantenmechanischer Effekt, der dafür verantwortlich ist, dass das Eisen unterhalb dieser Temperatur magnetisch ist und oberhalb nicht! Diese Temperatur wird auch als Curie-Temperatur bezeichnet (außer Eisen sind nur noch die Elemente Kobalt und Nickel bei Raumtemperatur ferromagnetisch). Der magnetische Zustand des Eisen mit seiner kubisch-raumzentrierten Gitterstruktur wird auch als (\alpha\)-Eisen bezeichnet.
Als Curie-Temperatur bezeichnet man jene Temperatur ab der ein ferromagnetischer Stoff seine magnetischen Eigenschaften verliert!
Das unten abgebildete Gefügebild zeigt Weicheisen (α-Eisen) im nahezu kohlenstofffreien Zustand. Zu sehen sind die Eisenkörner (weiße Bereiche) und Silikateinschlüsse (dunkle Punkte).
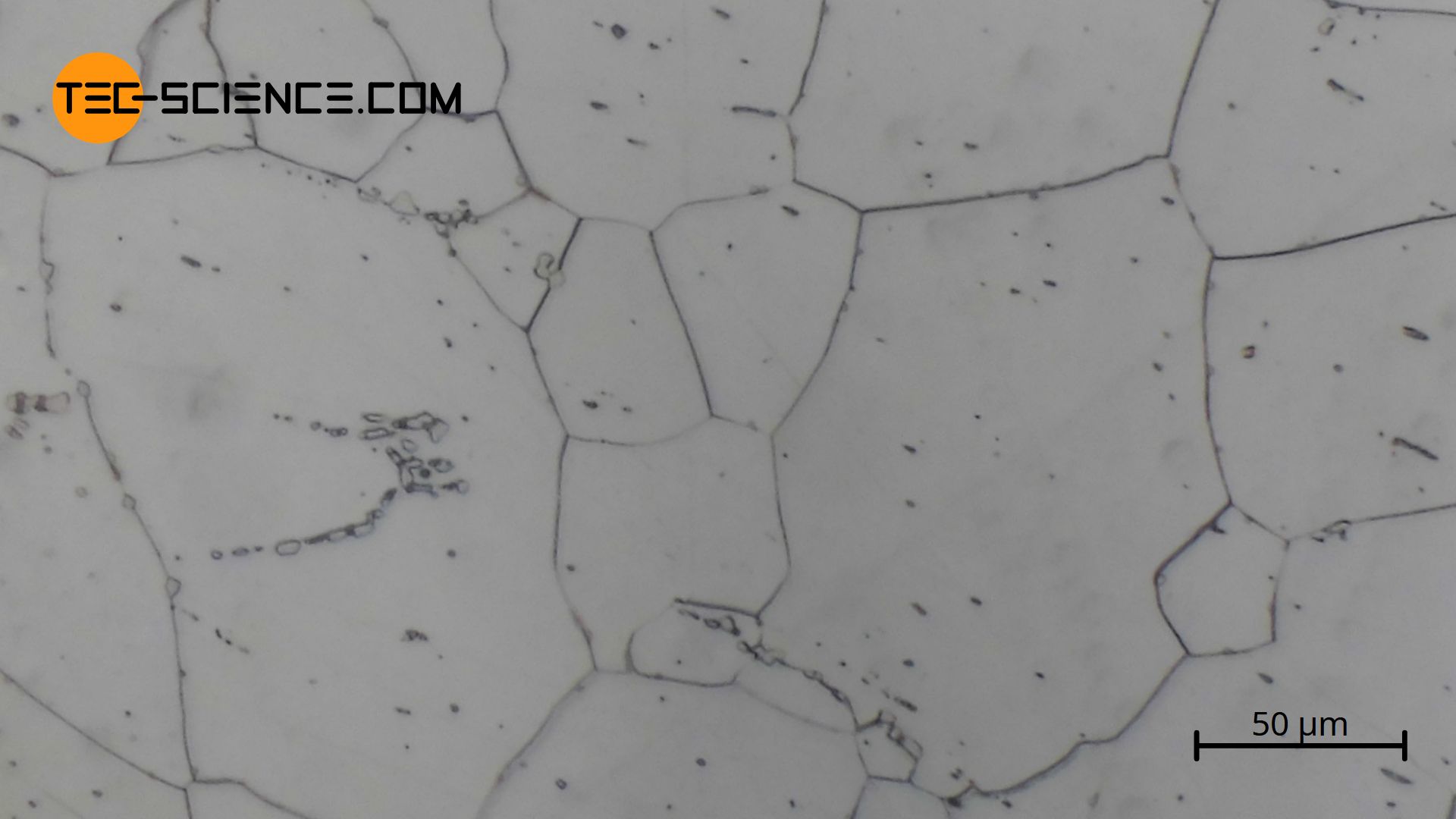
Nachdem nun die Gefügeumwandlungen des reinen Eisens erläutert wurden, wird im folgenden Artikel auf die Phasenumwandlungen in Anwesenheit von Kohlenstoff (Stahl) näher eingegangen.
Gefügeentstehung von Stahl
Im vorherigen Abschnitt wurden die Phasenumwandlungen von reinem Eisen näher betrachtet. Stähle bestehen neben Eisen jedoch noch aus Kohlenstoff. Dies führt allerdings dazu, dass sich die erläuterten Phasenumwandlungen des Eisens verschieben! Auf welche Weise der Kohlenstoff dabei die Zustandsänderungen beeinflusst kann am besten durch das entsprechende Phasendiagramm erläutert werden.
Das Zustandsdiagramm des Eisen-Kohlenstoff-Systems wird auch als Eisen-Kohlenstoff-Diagramm (EKD) bezeichnet. Aufgrund der Komplexität soll an dieser Stelle die Erstellung des Phasendiagrammes anhand ausgewählter Abkühlkurven nicht durchgeführt werden. Darüber hinaus wird das Eisen-Kohlenstoff-Diagramm in den folgenden Abschnitten zunächst nur bis zu einem Kohlenstoffgehalt von rund 2 % betrachtet, da nur dieser Bereich für Stähle relevant ist. Dieser Bereich im Eisen-Kohlenstoff-Diagramm wird deshalb auch als Stahlecke bezeichnet. Auf höhere Kohlenstoffkonzentrationen wird in separaten Abschnitten näher eingegangen.
Als Stahlecke bezeichnet man den Ausschnitt des Eisen-Kohlenstoff-Diagramms bis zu einem für Stähle relevanten Kohlenstoffgehalt von 2 %!
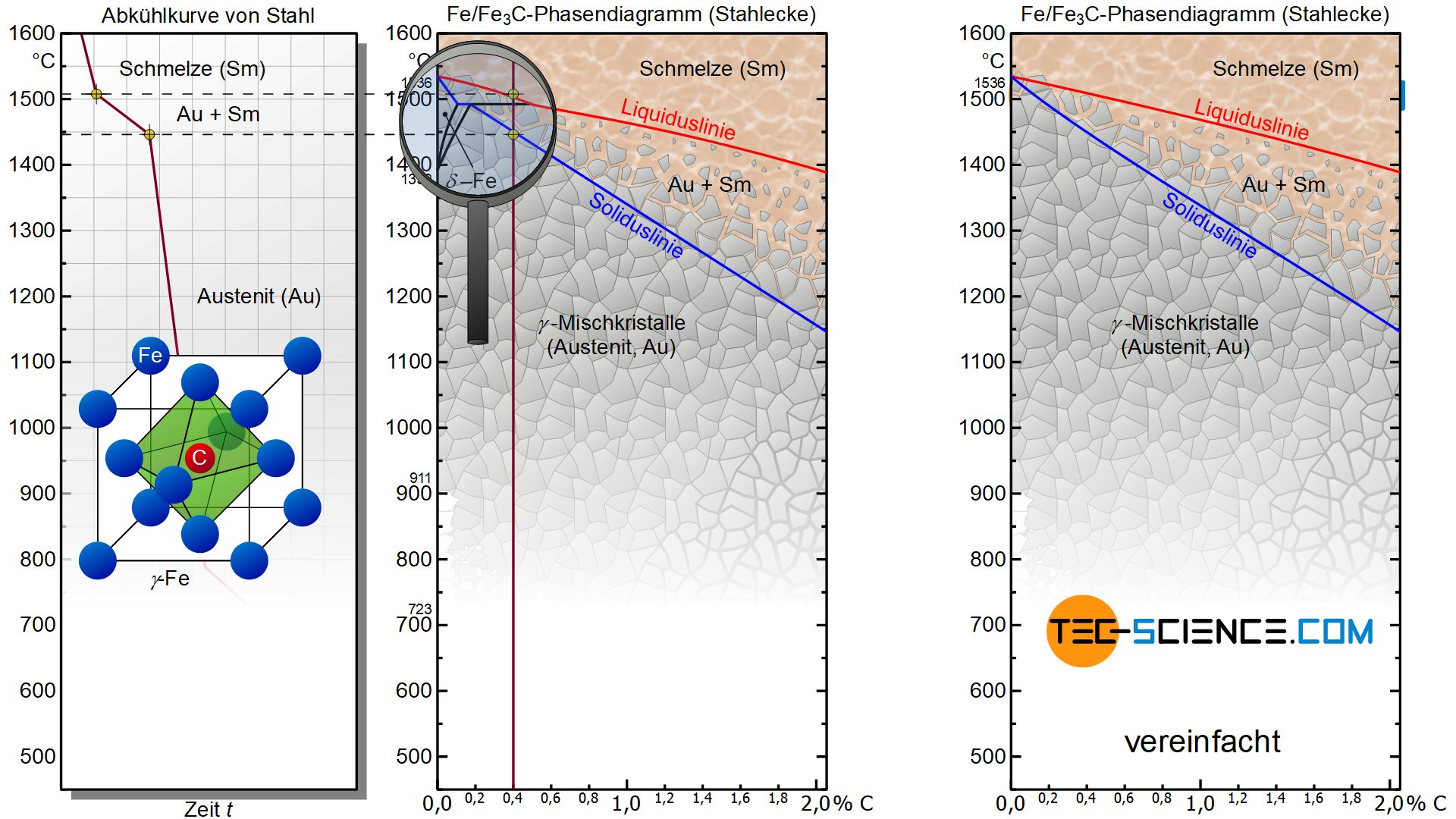
Der Kohlenstoff beeinflusst die Erstarrung des Stahls zunächst wie eine Mischkristalllegierung. Die Stahlecke weist deshalb den typisch linsenförmigen Zweiphasenbereich während der Erstarrung auf. Der Erstarrungsbeginn wird wiederum durch die Liquiduslinie und das Erstarrungsende durch die Soliduslinie beschrieben. Zwischen diesen Linien erfolgt die Gefügebildung mit entsprechend verlangsamter Abkühlgeschwindigkeit. Aus dem Phasendiagramm wird offensichtlich, dass sich der Erstarrungsbereich mit zunehmendem Kohlenstoffgehalt zu niedrigeren Temperaturen hin verschiebt.
Der Kohlenstoff verschiebt den Erstarrungsbereich des Stahls hin zu niedrigeren Temperaturen!
Darüber hinaus führt der Kohlenstoff bereits in geringen Mengen (> 0,1%) dazu, dass die kubisch-raumzentrierte \(\delta\)-Phase vollständig unterdrückt wird. Der Stahl kristallisiert dann sofort in der kubisch-flächenzentrierten Gitterstruktur des \(\gamma\)-Eisens. Da die \(\delta\)-Phase ohnehin keinerlei technische Bedeutung hat, wird das Zustandsdiagramm sehr häufig in vereinfachter Form ohne diesen Phasenbereich dargestellt.
Stähle verhalten sich während der Erstarrung wie Mischkristalllegierungen, bei denen das Legierungselement Kohlenstoff vollständig im Basisstoff Eisen löslich ist.
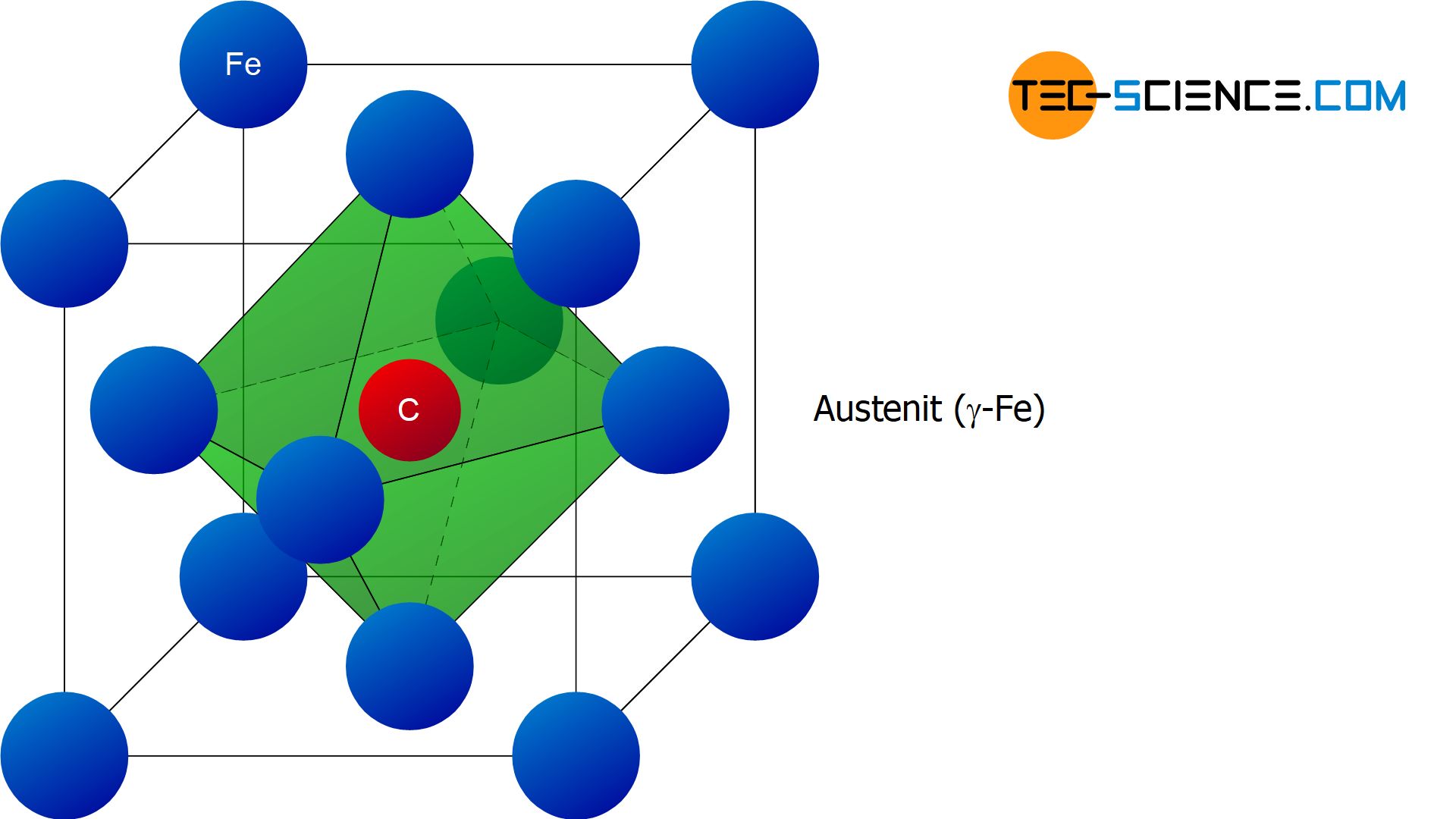
Die gute Löslichkeit des Kohlenstoffs ist dabei der kubisch-flächenzentrierten Gitterstruktur des \(\gamma\)-Eisens zu verdanken. Die relativ kleinen Kohlenstoffatome finden dabei in den freien Würfelmitten der kubisch-flächenzentrierten Elementarzellen des Eisens Platz. Da das Kohlenstoffatom in dieser freien Lücke von 6 Eisenatomen umgeben ist, die die Eckpunkte eines Oktaeders beschreiben, wird diese Lücke in der Würfelmitte auch also Oktaederlücke bezeichnet.
Es handelt sich in diesem Fall also um einen Einlagerungsmischkristall, bei dem das Kohlenstoffatom auf den Zwischengitterplätzen des Eisens eingelagert ist. Dieses aus der Schmelze heraus entstandene kubisch-flächenzentriearte Eisengefüge mit den darin eingelagerten Kohlenstoffatomen wird auch als Austenit bezeichnet.
Als Austenit bezeichnet man die kubisch-flächenzentrierte Gitterstruktur des \(\gamma\)-Eisens mit darin eingelagerten Kohlenstoffatomen in den Oktaederlücken (Mischkristall)!
Dementsprechend enthält das Zweiphasengebiet zwischen der Liquidus- und der Soliduslinie die Phasen Schmelze (Sm) und Austenit (Au). Im Zweiphasengebiet können die jeweiligen Kohlenstoffkonzentrationen der beiden Phasen wie üblich über das Fällen des Lotes auf die Konzentrationsachse ermittelt werden. Die Phasenanteile bestimmen sich dabei wiederum mithilfe des Hebelgesetzes (mehr Informationen hierzu siehe Kapitel Mischkristalllegierungen).
Es finden bei der Erstarrung von Stählen also dieselben Mechanismen wie bei einer Mischkristalllegierung Anwendung. Dies gilt allerdings nur solange wie die Temperaturen ausreichend hoch sind und das Eisen somit im kubisch-flächenzentriertem Zustand vorliegt. Denn nur dann ist der Kohlenstoff vollständig im Eisengitter löslich und die Legierung kann als Mischkristalllegierung angesehen werden.
Die Phase Austenit existiert nur bei ausreichend hohen Temperaturen, solange das Eisen in der kubisch-flächenzentrierten Struktur vorliegt!
Allerdings ändert Eisen bedingt durch seine Allotropie bei Absenken der Temperatur irgendwann die kubisch-flächenzentrierte Struktur und geht schließlich in das kubisch-raumzentrierte \(\alpha\)-Eisen über. Mit sinkender Temperatur ist also eine weitere Phasenumwandlung verbunden, die nunmehr allerdings im bereits erstarrten Gefüge stattfindet! Auf diese Umwandlung wird im nächsten Abschnitt näher eingegangen werden.
Kohlenstoffausscheidung (\(\gamma\)-\(\alpha\)-Umwandlung)
Reines Eisen ändert bei Unterschreiten der Temperatur von 911 °C seine kubisch-flächenzentrierte \(\gamma\)-Eisen-Struktur und geht in die kubisch-raumzentrierte Gittermodifikation des \(\alpha\)-Eisens über. Diese Gitterumwandlung tritt prinzipiell auch in Anwesenheit des Kohlenstoffs auf, jedoch bei anderen Temperaturen!
Mit steigendem Kohlenstoffgehalt wird diese sogenannte \(\gamma\)-\(\alpha\)-Umwandlung zu niedrigeren Temperaturen hin verschoben. Darüber hinaus bewirkt der Kohlenstoff, dass sich diese Gitterumwandlung nicht mehr in einem Haltepunkt bei konstanter Temperatur vollzieht sondern in einem Temperaturbereich. Erst ab einem Kohlenstoffgehalt von 0,8 % bildet sich das \(\alpha\)-Eisen wieder bei konstanter Temperatur sodass die Linienzüge des Beginns und des Endes der \(\gamma\)-\(\alpha\)-Umwandlung im Phasendiagramm zusammenfallen.
Durch die Anwesenheit des Kohlenstoffs wird die \(\gamma\)-\(\alpha\)-Umwandlung zu niedrigeren Temperaturen hin verschoben!
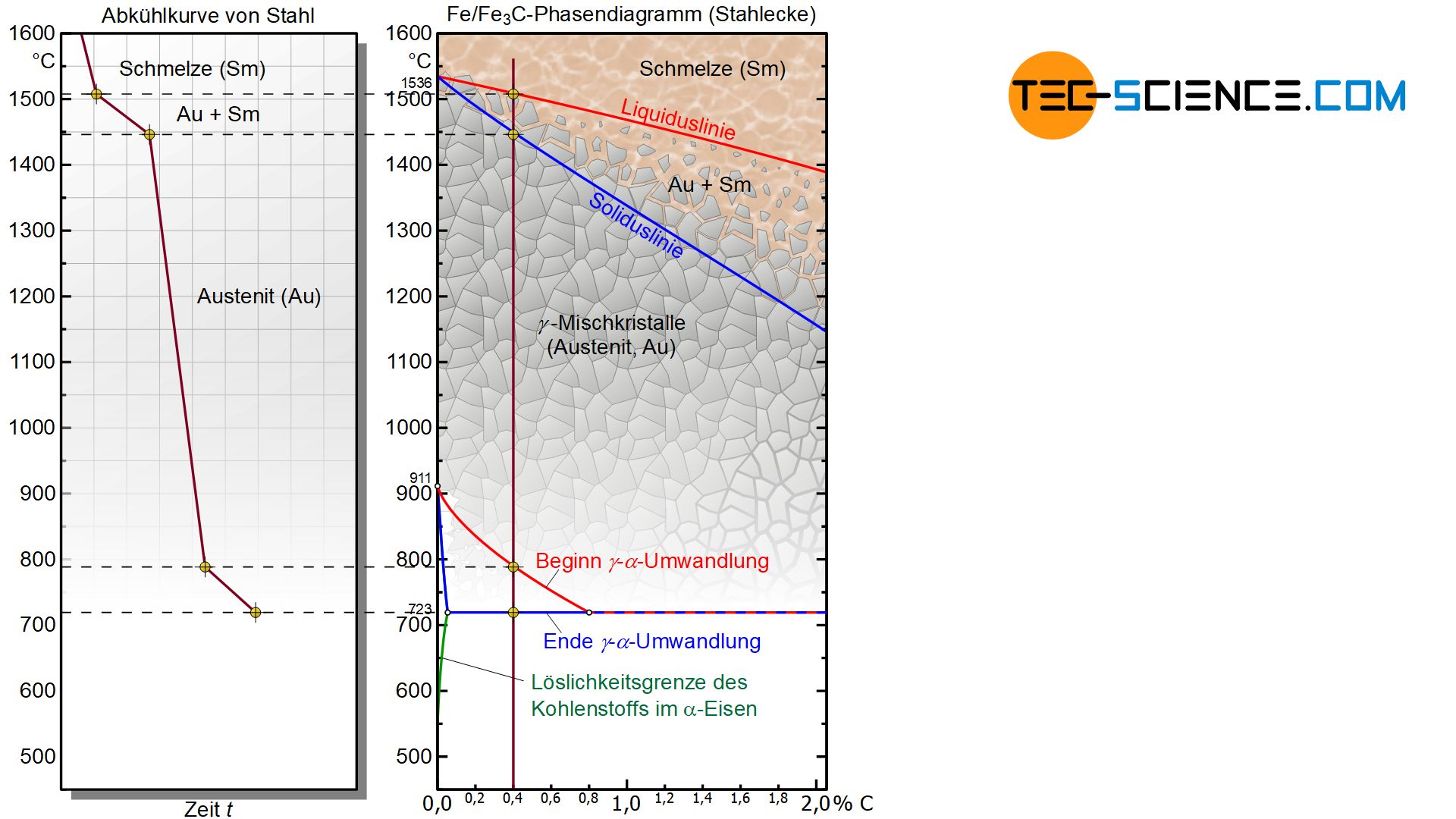
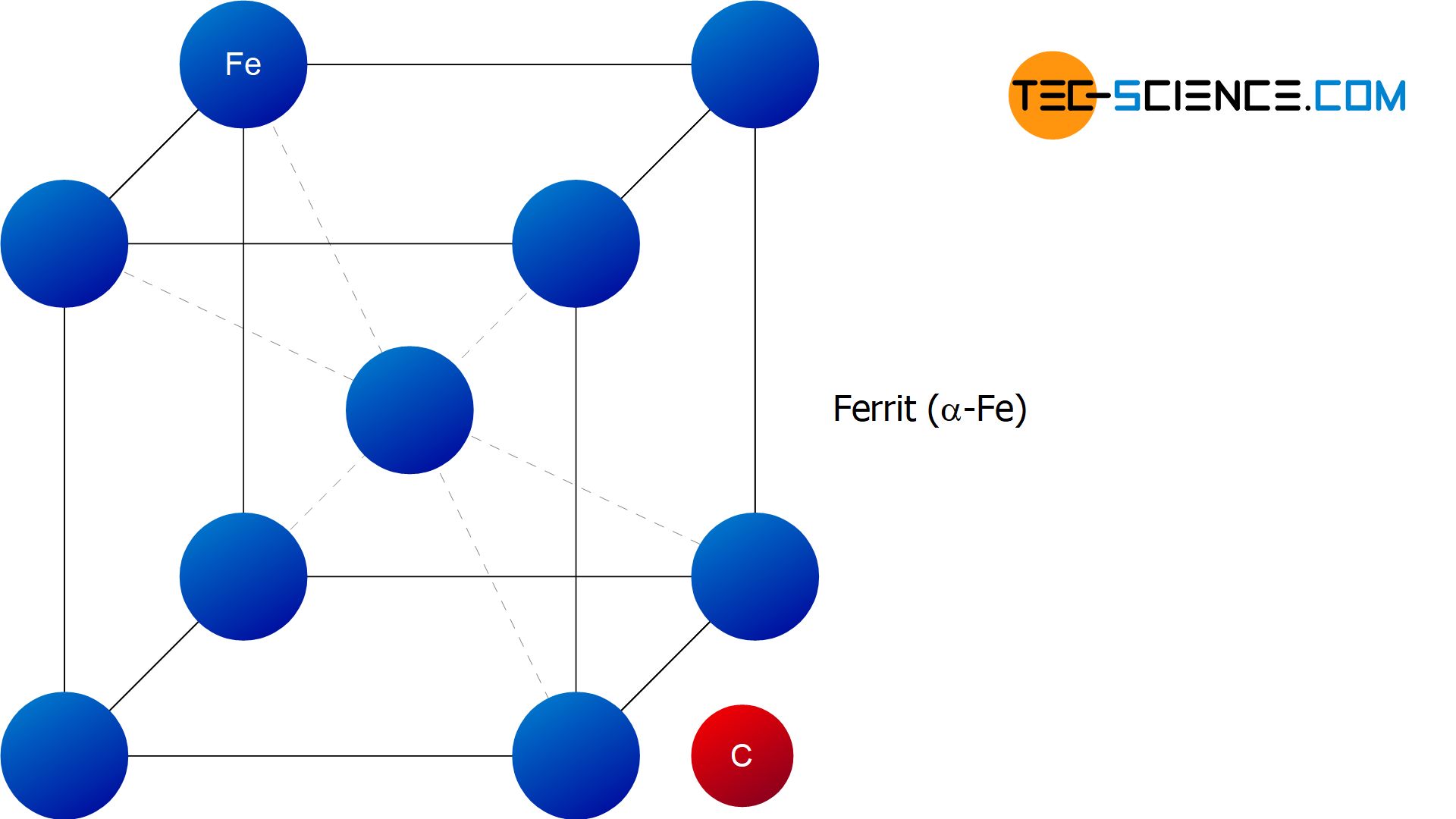
Im Gegensatz zu den \(\gamma\)-Mischkristallen sind die Elementarzellen des kubisch-raumzentrierten \(\alpha\)-Gitters in der Würfelmitte bereits durch ein Eisenatom besetzt. Die kubisch-raumzentrierte Gitterstruktur des \(\alpha\)-Eisens vermag deshalb nahezu keinen Kohlenstoff darin zu lösen. Die maximale Löslichkeit beträgt bei 723 °C lediglich 0,02 % und sinkt bei Raumtemperatur sogar auf unter 0,001% (die genaue Löslichkeitsgrenze ist im Diagramm mit einer grünen Line dargestellt). Vereinfachend soll deshalb im Folgenden davon ausgegangen, dass kein Kohlenstoff im \(\alpha\)-Gitter löslich ist.
Das zuvor im Austenit eingelagerte Kohlenstoffatom wird deshalb bei der \(\gamma\)-\(\alpha\)-Gitterumwandlung aus der Gitterstruktur „herausgepresst“. Somit handelt es sich im um ein nahezu kohlenstofffreies \(\alpha\)-Eisengitter. Im Gegensatz zur kohlenstoffhaltigen kubisch-flächenzentrierten \(\gamma\)-Struktur, die mit Austenit bezeichnet wurde, wird die nahezu kohlenstofffreie kubisch-raumzentrierte \(\alpha\)-Gitterstruktur auch Ferrit genannt.
Als Ferrit bezeichnet man die nahezu kohlenstofffreie kubisch-raumzentrierte Gitterstruktur des \(\alpha\)-Eisens!
Stabiles System
Während der \(\gamma\)-\(\alpha\)-Umwandlung kann sich der nicht mehr im \(\alpha\)-Eisen lösliche Kohlenstoff prinzipiell auf zweierlei Arten aus dem Gitter ausscheiden. Bei langsamer Abkühlung und einem relativ hohen Kohlenstoffgehalt finden die in hinreichender Zahl ausgeschiedenen Kohlenstoffatome genügend Zeit sich in einer eigenen hexagonalen Gitterstruktur zusammen zu lagern. In dieser Gittermodifikation bezeichnet man den Kohlenstoff auch als Graphit.
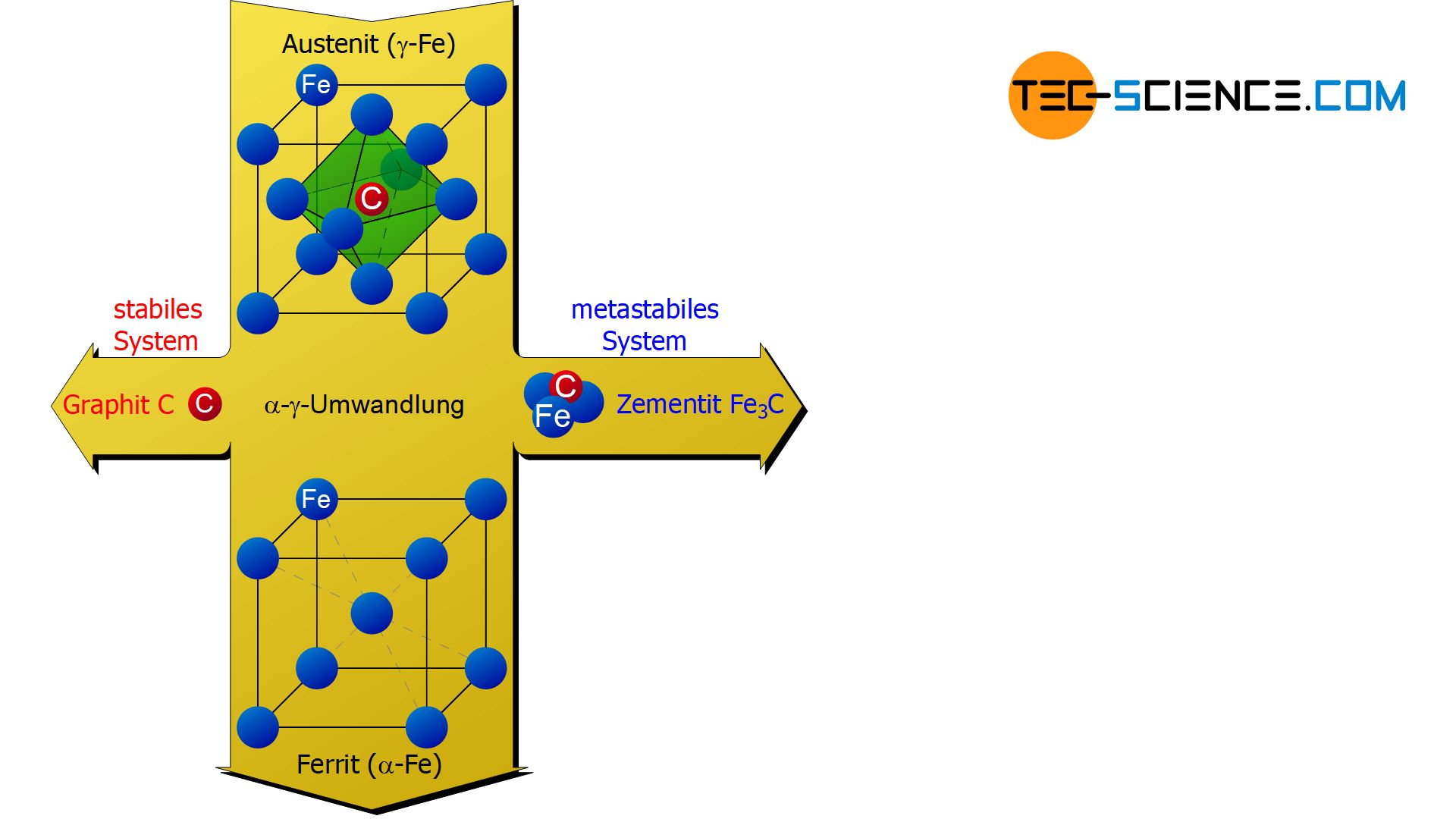
Eine solche Graphitausscheidung wird nicht nur durch relativ langsame Abkühlgeschwindigkeiten begünstigt sondern kann auch durch Hinzugeben von Silizium gezielt gefördert werden. Die Ausscheidung des Kohlenstoffs in Form von Graphit wird auch als sogenanntes stabiles System bezeichnet, da der Kohlenstoff in dieser Form nicht mehr weiter zerfallen kann und damit im thermodynamischen Sinne stabil ist.
Ein nach dem stabilen System erstarrtes Gefüge besteht grundsätzlich aus Eisen (Fe) und Graphit (C). Dies gilt insbesondere für Gusseisen!
Gusseisen weist in der Regel einen relativ hohen Kohlenstoffgehalt auf (> 2 %) und ist somit ein typischer Vertreter des stabilen Systems. Manche Gusseisensorten erstarren jedoch auch nach dem nachfolgend erläuterten metastabilen System. Dies gilt insbesondere für Stähle.
Metastabiles System
Wird das erstarrte Gefüge nicht mehr relativ langsam sondern schneller abgekühlt und sind nur geringe Mengen an Kohlenstoff vorhanden, so können sich die Kohlenstoffatome nicht mehr zu einer gemeinsamen Graphit-Gitterstruktur anlagern. In diesem Fall verbindet sich der ausscheidende Kohlenstoff mit drei Eisenatomen zu der Eisencarbidverbindung Fe3C und bildet eine rhomboedrische Gitterstruktur. Diese intermediäre (intermetallische) Eisencarbid-Verbindung wird auch als Zementit bezeichnet.
Als Zementit bezeichnet man die relativ harte aber spröde intermetallische Verbindung bestehend aus drei Eisenatomen und einem Kohlenstoffatom (Fe3C)!
Wie der Name bereits vermuten lässt, ist Zementit sehr hart und maßgeblich für die Härtesteigerung des Stahls verantwortlich! Die Zementitausscheidung kann nicht nur durch eine schnellere Abkühlung erreicht werden sondern auch gezielt durch Zusätze wie Mangan gefördert werden. Die Ausscheidung des Kohlenstoffs in Form von Zementit wird im thermodynamischen Sinne auch metastabiles System genannt, da die Eisencarbid-Verbindung bei ausreichend hohen Temperaturen und hinreichend langen Glühzeiten durch Diffusionsprozesse in die thermodynamisch stabile Graphitform zerfallen würde.
Im Gegensatz zu Gusseisen weisen Stähle in der Regel einen relativ niedrigen Kohlenstoffgehalt auf (< 2 %) und sind deshalb typische Vertreter des metastabilen Systems.
Ein nach dem metastabilen System erstarrtes Gefüge besteht grundsätzlich aus Eisen (Fe) und Zementit (Fe3C). Dies gilt insbesondere für Stähle!
Je nach Ausscheidung des Kohlenstoffes in Form Graphit oder Zementit unterscheiden sich die Linienzüge im Eisen-Kohlenstoff-Diagramm leicht voneinander (mehr hierzu im Kapitel Gusseisen). Da das metastabile System mit seiner Zementitausscheidung vor allem für Stähle besondere Bedeutung hat, wird in den folgenden Kapiteln lediglich auf dieses metastabile System näher eingegangen.