Stoffe sind aus mikroskopischen Einheiten aufgebaut, den sogenannten Atomen. Ein Atom besteht aus einem positiven Atomkern (Protonen und Neutronen) und einer negativen Atomhülle (Elektronen).
Atomarer Aufbau
Stoffe sind aus mikroskopischen Einheiten aufgebaut, den sogenannten Atomen. Chemische Elemente setzen sich aus Atomen einer bestimmten Atomsorte zusammen. Die Einteilung der Elemente erfolgt nach dem Periodensystem. Reagieren mehrere unterschiedliche Atome (chemische Elemente) miteinander und bilden eine stabile Einheit, so spricht man von Molekülen.
Moleküle sind stabile Ansammlungen von verschiedenen chemischen Elementen.
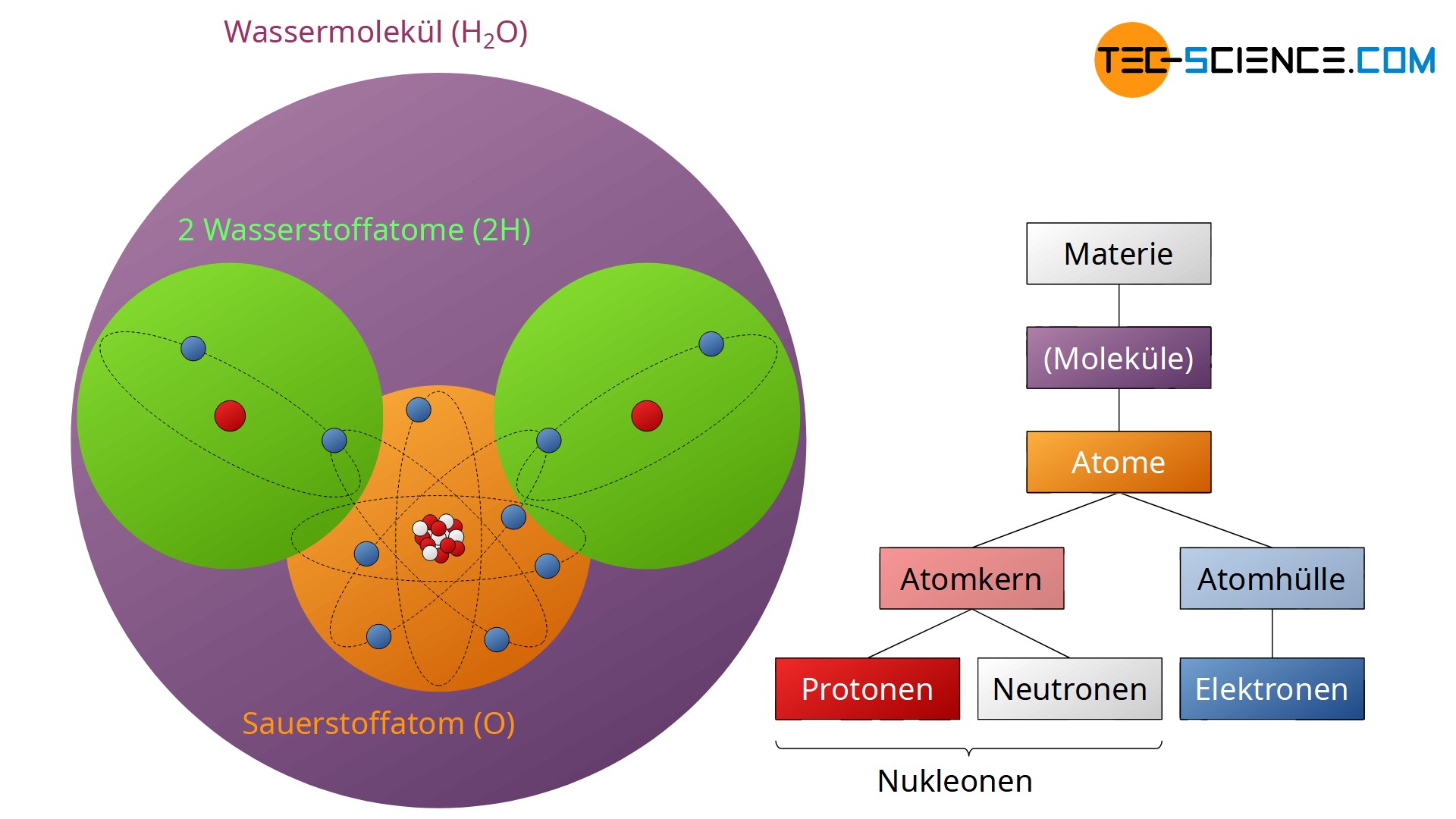
Wasser besteht bspw. aus den Elementen Wasserstoff und Sauerstoff. Dabei schließen sich jeweils zwei Wasserstoffatome (H) und ein Sauerstoffatom (O) zu einem H2O-Molekül zusammen. Die atomaren Einheiten wie Moleküle, Atome, Protonen, Neutronen, Elektronen, etc. werden auch kurz als Teilchen bezeichnet. Man spricht in diesem Zusammenhang deshalb auch oft vom sogenannten Teilchenmodell, mit dem man den Aufbau der Materie beschreibt.
Im Teilchenmodell wird der Aufbau der Materie mithilfe von Teilchen beschrieben ohne dabei näher zwischen Atomen, Moleküle, etc. zu unterscheiden.
Atome bestehen nach dem Rutherfordschen Atommodell aus einem elektrisch positiv geladenen Atomkern und einer elektrisch negativ geladenen Elektronenhülle. Im Atomkern befinden sich die elektrisch positiv geladenen Protonen. Diese bilden die positive Ladung des Atomkerns. Die wirkende Abstoßungskraft zwischen den Protonen wird durch die starke Anziehungskraft der ebenfalls im Atomkern vorhandenen Neutronen ausgeglichen. Die Neutronen selbst sind zwar elektrisch neutral, sie üben aber dennoch eine starke Anziehungskraft auf die Protonen aus. Auf diese Weise werden die Protonen stabil im Kern zusammengehalten.
Die Kernteilchen (Protonen und Neutronen) werden auch als Nukleonen bezeichnet (lat. nucleus = „Kern“).
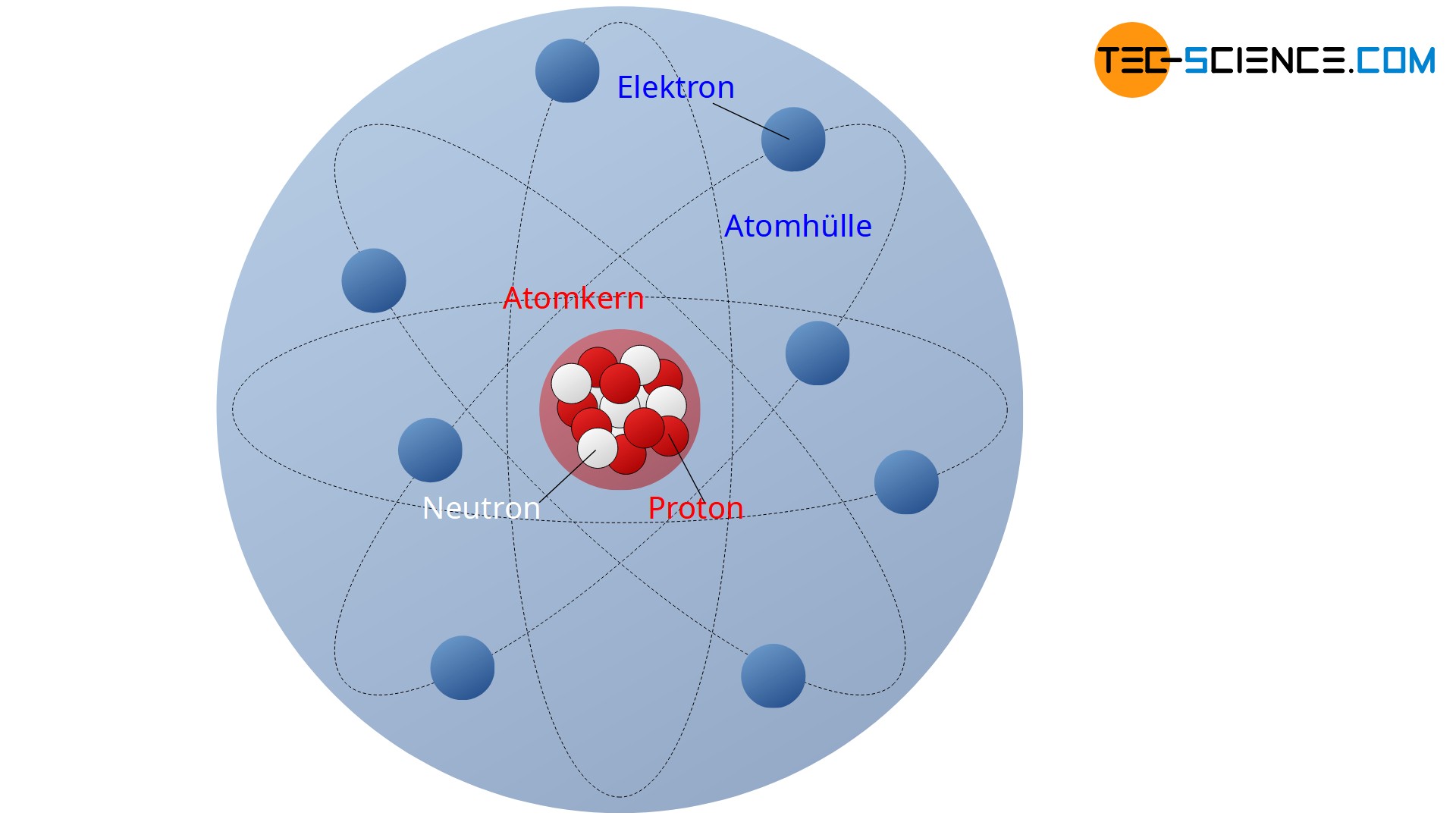
Die Anziehungskraft zwischen den Kernteilchen kann aufgrund der elektrischen Neutralität der Neutronen nicht elektrostatischer Natur sein. Es handelt sich vielmehr um eine weitere Art der Kraftwirkung. Sie wird als starke Kernkraft oder auch als starke Wechselwirkung bezeichnet. Sie zählt neben der elektromagnetischen Kraft, der Gravitationskraft und der schwachen Wechselwirkung zu den insgesamt vier Grundkräften der Physik zählt.
Die Reichweite der starken Kernkraft ist zwar sehr gering, bei ausreichend kleinen Abständen wie dies in Atomkernen der Fall ist, ist sie jedoch äußerst stark. Die starke Wechselwirkung zwischen den Protonen und Neutronen ist letztlich der Grund weshalb diese Kernkraft gegenüber den Abstoßungskräften der Protonen überwiegt und somit den Atomkern stabil zusammenhält. Die Neutronen bilden sozusagen den „Klebstoff“ des Atomkerns.
Die starke Wechselwirkung (starke Kernkraft) zwischen den Nukleonen hält den Atomkern stabil zusammen.
Um den positiven Atomkern herum befindet sich die Elektronenhülle. Sie wird von den elektrisch negativ geladenen Elektronen gebildet. In einer stark vereinfachten Vorstellung umkreisen die Elektronen in dieser gedachten Hülle den positiven Atomkern. Die elektrostatischen Anziehungskräfte zwischen dem positiven Atomkern und den negativen Elektronen sorgen dafür, dass die umkreisenden Elektronen stabil auf der Bahn um den Atomkern gehalten werden und das Atom nicht auseinanderfällt.
Die Elektronenhülle ist eine gedachte Hülle in welcher die Elektronen den Atomkern stabil umkreisen.
Ordnungszahl
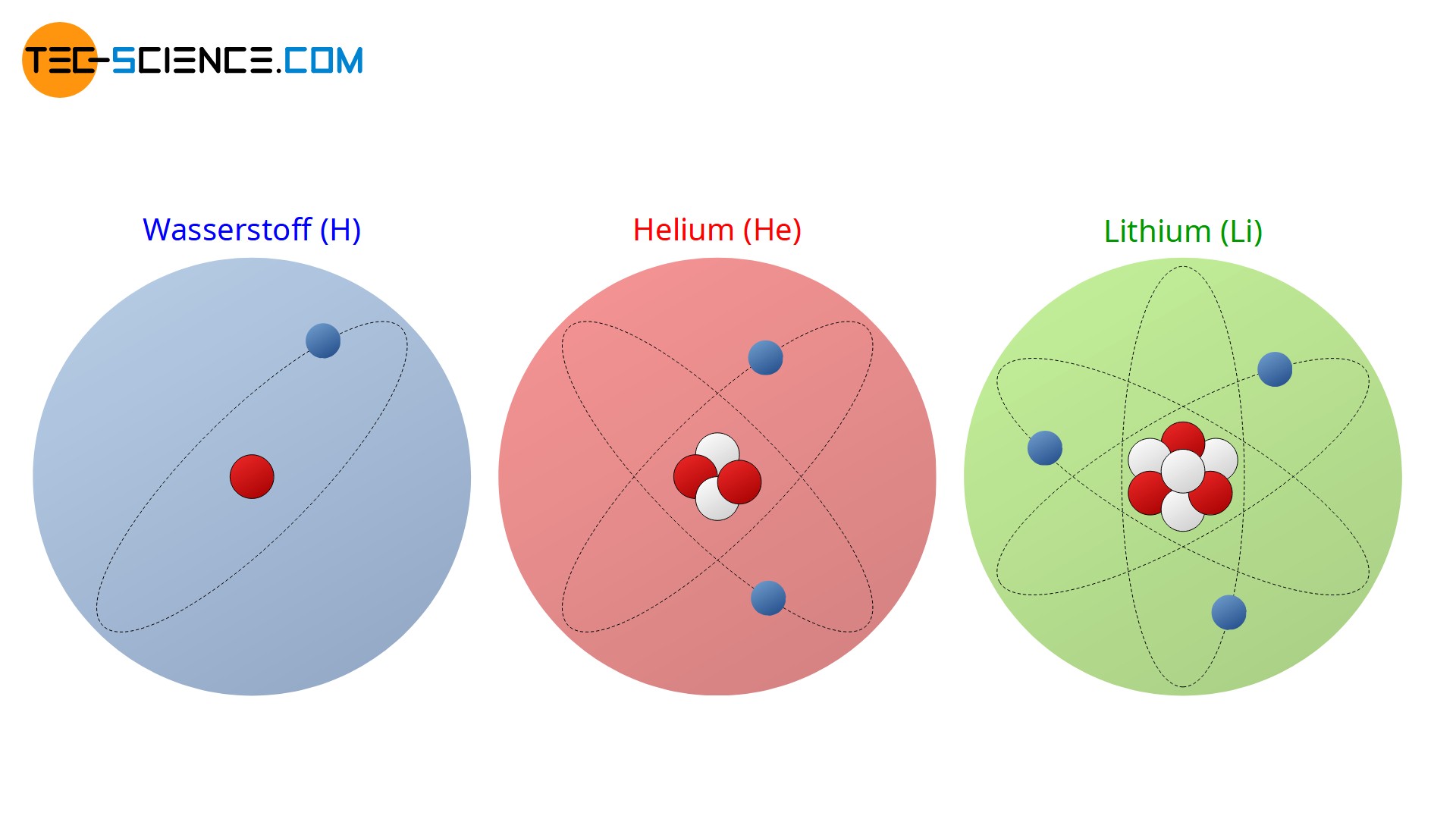
Charakteristisch für eine bestimmte Atomart bzw. für ein chemisches Element ist die Anzahl der Protonen im Kern! Die Protonenanzahl bestimmt wesentlich das chemische Verhalten des Elements und ist für die Ordnungsreihenfolge im Periodensystem verantwortlich. Man bezeichnet die Protonenanzahl deshalb auch oft als Ordnungszahl (Kernladungszahl). Ein Wasserstoffatom besitzt bspw. stets ein Proton im Kern. Würde es zwei oder drei Protonen im Kern beherbergen, so wäre es kein Wasserstoffatom mehr sondern ein Heliumatom (2 Protonen) bzw. ein Lithiumatom (3 Protonen).
Die Anzahl der Protonen im Kern (Ordnungszahl) bestimmt das chemische Element.
Isotope
Im Gegensatz zur Protonenzahl ist die Neutronenzahl hingegen nicht charakteristisch für ein chemisches Element. So besitzt ein Lithiumatom zwar in der Regel vier Neutronen im Kern; dies trifft allerdings nur für 92,5 % aller Lithiumatome zu. Die restlichen 7,5 % der in der Natur vorkommenden Lithiumatome beinhalten im Kern lediglich drei Neutronen. Solche Abwandlungen von Atomen, die zwar zum selben chemischen Element gehöhren und somit dieselbe Protonenzahl aufweisen, aber eine unterschiedliche Anzahl an Neutronen besitzen, werden auch als Isotope bezeichnet. Das Lithiumatom besitzt folglich zwei (stabile) Isotope.
Isotope haben dieselbe Anzahl an Protonen aber unterschiedliche Neutronenzahlen.
Das Wasserstoffatom besitzt sogar drei Isotope. Das mit 99,98 % am häufigsten vorkommende Wasserstoffisotop ist jenes ohne ein Neutron im Kern. Dieses Wasserstoffatom besitzt folglich nur ein Proton als Kernteilchen und wird deshalb auch als Protium genannt (Symbol: H).
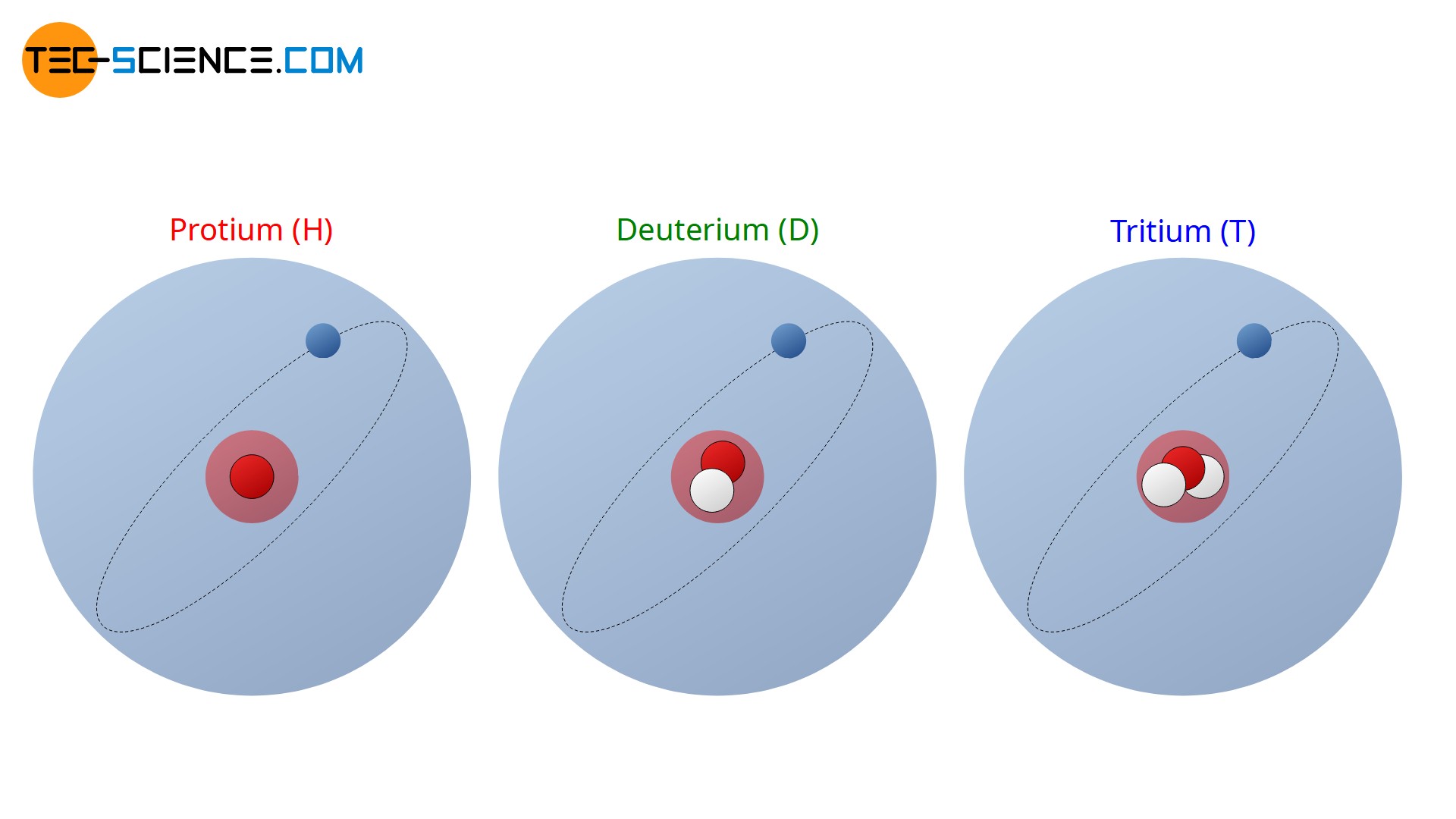
Besitzt der Wasserstoff zusätzlich zum Proton noch ein Neutron, so bezeichnet man dieses Isotop als Deuterium (Symbol: D). Deuterium ist mit einem Anteil von nur 0,015 % aller in der Natur vorkommenden Wasserstoffatome vertreten.
Ein weiteres Wasserstoffisotop besitzt sogar zwei Neutronen im Kern und wird als Tritium bezeichnet (Symbol: T). Dieses Isotop nimmt nur einen verschwindend geringen Anteil am gesamten Wasserstoffaufkommen in der Natur ein. Im Gegensatz zum Protium und Deuterium ist Tritium jedoch nicht stabil und zerfällt mit einer Halbwertszeit von rund 12 Jahren. Aufgrund der stattfindenden Zerfallsprozesse ist Tritium folglich radioaktiv.
Ionen
Im elektrisch neutralen Zustand befinden sich im Kern eines Atoms genauso viele positiv geladene Protonen wie Elektronen in der umgebenden Hülle. Die elektrische Ladung eines Elektrons und eines Protons ist zwar betragsmäßig identisch, jedoch mit umgekehrtem Vorzeichen. Über eine makroskopische Distanz betrachtet, heben sich somit die elektrostatischen Wirkungen gegenseitig auf. In diesem Zustand ist das Teilchen nach außen elektrisch neutral. Wird dieser elektrisch neutrale Zustand durch Aufnahme oder Wegnahme von Elektronen allerdings gestört so spricht man von Ionen. Der Vorgang selbst wird Ionisation genannt.
Bei Elektronenüberschuss ist das Atom nach außen hin elektrisch negativ geladen. Man spricht dann auch von einem negativ geladenen Ion bzw. von einem Anion. Umgekehrt bezeichnet man ein elektrisch positiv geladenes Atom als Kation. Da die Anzahl der Protonen eines Atoms elementspezifisch ist kann ein Ion nur durch Abgabe oder Aufnahme von Elektronen entstehen, nicht durch Aufnahme oder Abgabe eines Protons! Denn durch Ändern der Protonzahl würde ein ganz anderes Element entstehen.
Ein Ion ist ein elektrisch geladenes Atom (oder Gruppe von Atomen). Ein negativ geladenes Atom wird Anion genannt und ein positiv geladenes Atom Kation.
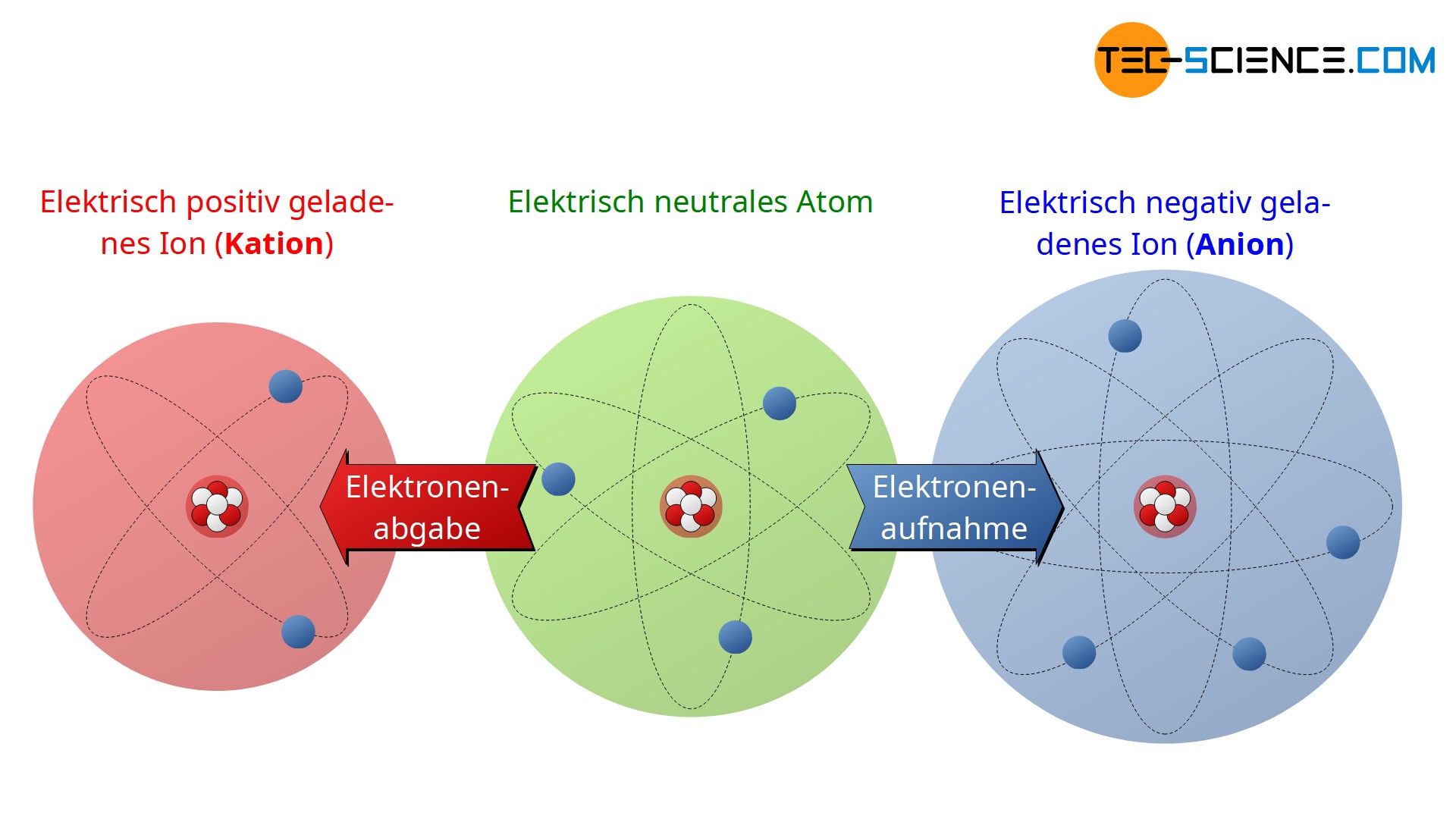
Beachte, dass Anionen aufgrund des Elektronenüberschusses größer im Durchmesser sind als das entsprechende Atom und Kationen folglich kleiner aufgrund der fehlenden Elektronen.