Gemäß des Rutherfordschen Atommodells bewegen sich negativ geladene Elektronen um einen positiv geladenen Atomkern.
Im Jahre 1910 stellte der Physiker Ernest Rutherford beim Beschuss einer dünnen Goldfolie mit α-Teilchen (zweifach positiv geladene Heliumkerne mit zwei Neutronen \( ^4_2\text{He}^{2+} \)) fest, dass nur sehr wenige dieser Teilchen mit den Atomkernen der Goldfolie zusammenstießen. Nahezu alle α-Teilchen flogen geradlinig durch die Folie, während nur ein sehr geringerer Anteil von dieser geradlinigen Flugbahn abgelenkt wurde.
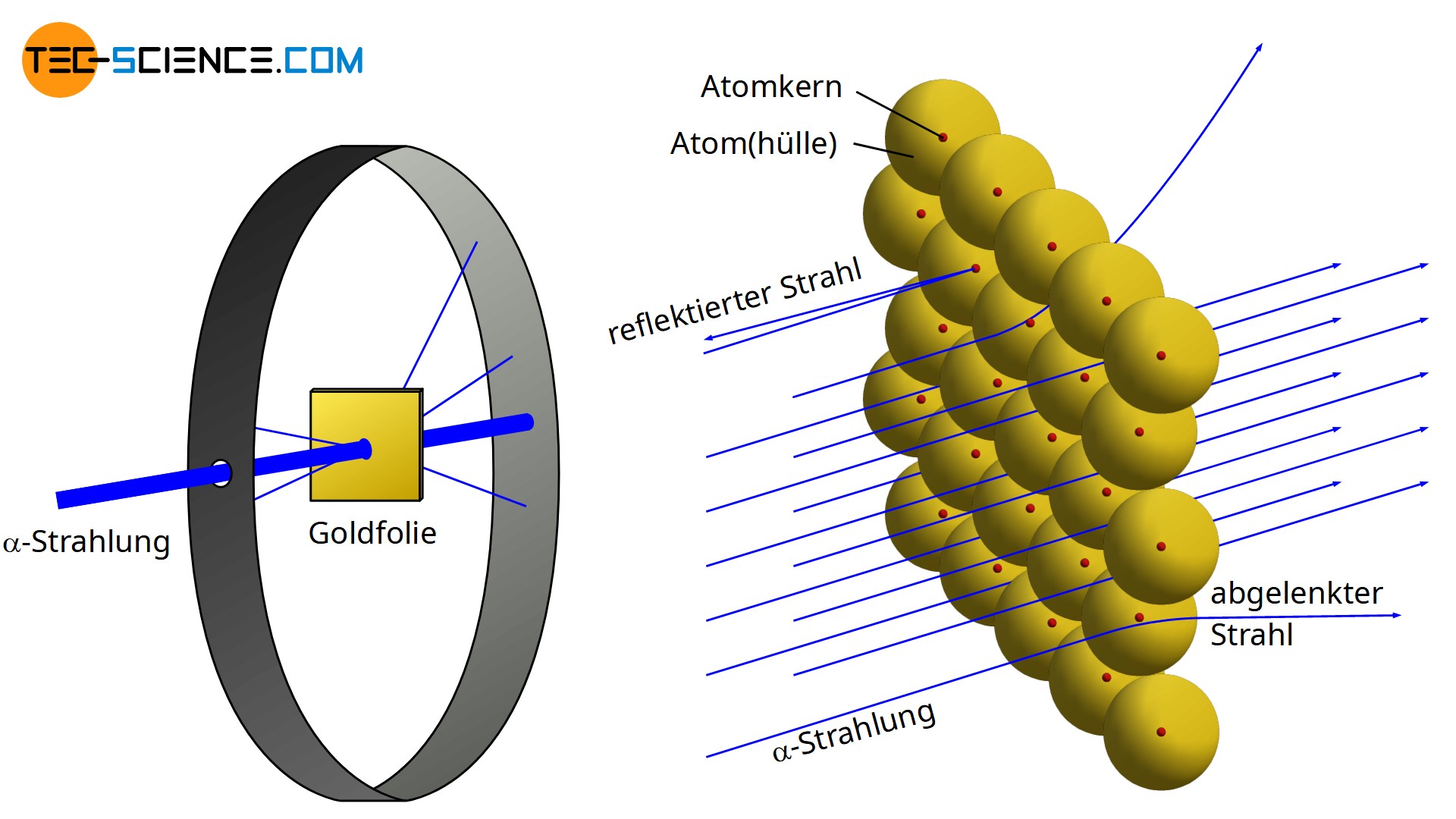
Offensichtlich kamen nur sehr wenige α-Teilchen nahe genug an den positiven Atomkern der Goldatome, dass diese durch die wirkenden Abstoßungskräfte in nennenswertem Maße abgelenkt werden konnten. In den meisten Fällen durchquerten die α-Teilchen die Goldfolie in weitem Abstand zu den jeweiligen Atomkernen und wurden kaum in ihrer Flugbahn beeinflusst. Aus diesem Versuch konnte gefolgert werden, dass der Atomkern wesentlich kleiner im Vergleich zum restlichen Atom bzw. zu seiner Atomhülle sein müsste.
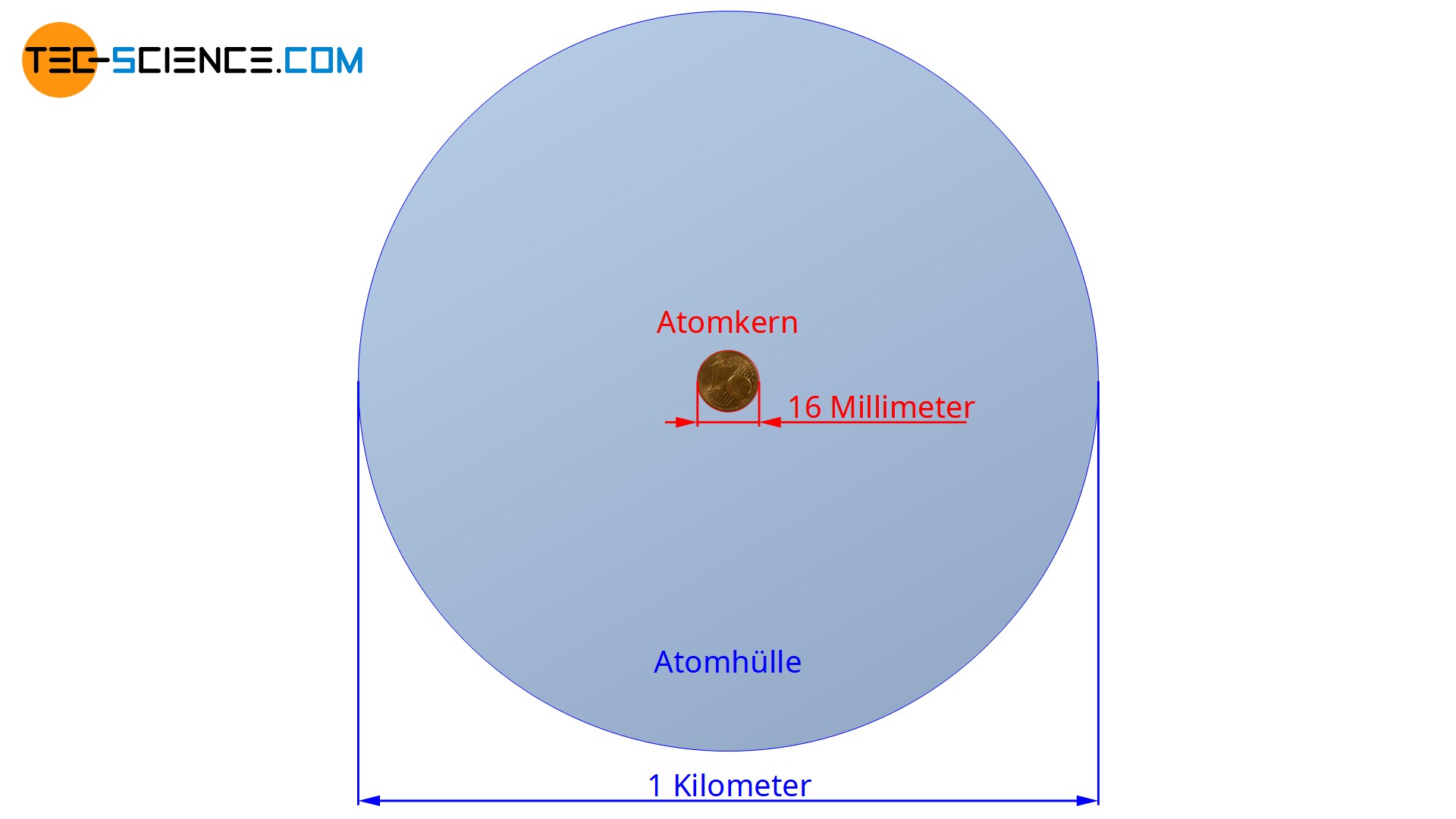
Heute weiß man, dass der Atomkern einen um den Faktor 10.000 bis 100.000 geringeren Durchmesser als die umgebende Atomhülle hat! Hätte der Atomkern die Größe einer 1-Cent-Münze, so betrüge der Durchmesser der Atomhüllte in diesem Maßstab rund 1 km!
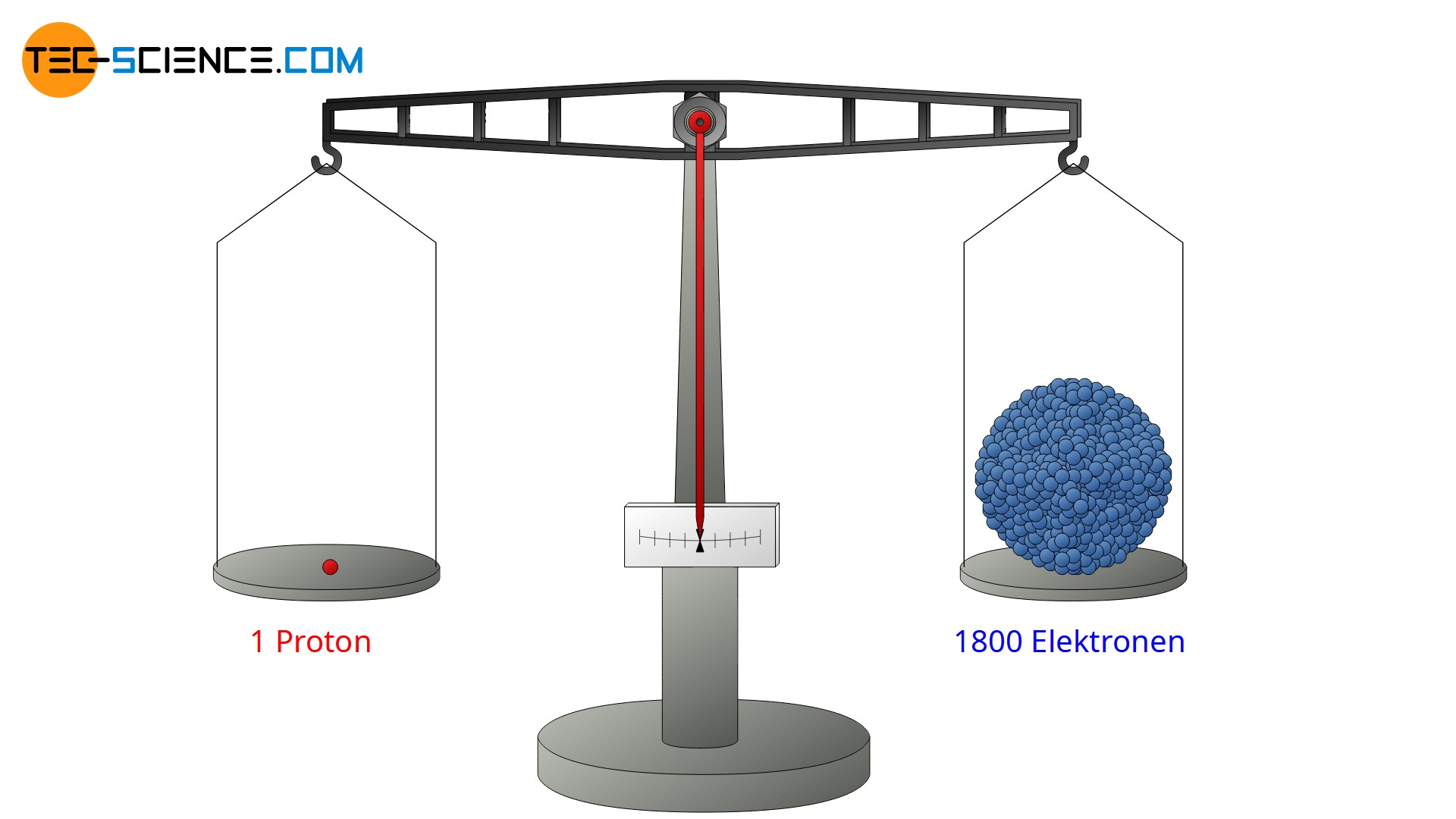
Der Goldfolienversuch zeigte weiter, dass einige αα-Teilchen an der Goldfolie mit nahezu keinem Energieverlust zurückreflektiert wurden. Sie mussten offensichtlich auf etwas sehr massives und schweres getroffen sein (analog zu einem Tennisball, der auf eine massive Betonwand trifft und mit nahezu derselben Geschwindigkeit wieder zurückfliegt). Hieraus folgerte Rutherford, dass nahezu die gesamte Masse eines Atoms im Kern konzentriert sein muss, um eine solch starke Reflektionswirkung zu erzeugen. Und tatsächlich ist nahezu 99,9% der Gesamtmasse eines Atoms in dessen Kern enthalten. Nur 0,1 % der Masse entfällt folglich auf die Atomhülle. Heute weiß man, dass ein Proton bzw. ein Neutron eine ca. 1800-fach so große Masse wie ein Elektron in der Hülle aufweist.
Diese Erkenntnisse bildeten die Grundlage für das nach Rutherford benannte Rutherfordsche Atommodell, dessen Kernaussagen nachfolgend nochmals kurz zusammengefasst sind:
- ein Atom besteht aus einem Atomkern und einer Atomhülle,
- der Atomkern ist positiv geladen und die Atomhülle negativ,
- im Atomkern sind positiv geladene Protonen und Neutronen,
- in der Atomhülle befinden sich die negativ geladenen Elektronen,
- der Atomkern ist wesentlich kleiner als die Atomhülle und
- nahezu die gesamte Atommasse entfällt auf den Kern.
Mit dem Rutherfordschen Atommodell konnten die Ergebnisse von Streuversuchen (wie eben die des Goldfolienexperimentes) richtig erklärt werden. Auch die grundlegenden Massen- und Größenverhältnisse sowie die entsprechende Aufteilung in Atomkern und Atomhülle spiegelt dieses Atommodell wieder.
Nicht beantwortet werden kann mit diesem Modell jedoch bspw. die Frage, weshalb Atome nur mit bestimmten Energien angeregt werden können. Oder weshalb Atome charakteristische Linienspektren aussenden. Ebenfalls liefert das Rutherfordsche Atommodell keine Erklärung weshalb ein Atom stabil ist, denn die kreisförmige Bewegung der Elektronen um den Kern müsste eigentlich zu einer Energieabstrahlung führen. Die Elektronen sollten demnach bereits nach kurzer in dern Kern stürzen und kein Atom dürfte folglich stabil sein!
Einige der Schwächen des Rutherfordschen Atommodells konnte der Physiker Niels Bohr in seinem Atommodell beheben (Bohrsches Atommodell).
Anmerkung
Modelle (wie bspw. die Atommodelle oder auch das Teilchenmodell) erheben grundsätzlich nie den Anspruch auf eine vollkommene Beschreibung der Realität. Modelle sind immer Versuche die Wirklichkeit innerhalb bestimmter Grenzen abzubilden und erklärbar zu machen.
Das Rutherford’sche Atommodell ist also nicht grundsätzlich „falsch“ sondern besitzt lediglich Grenzen der Gültigkeit. Das Rutherford’sche Atommodell hat somit nicht ausgedient sondern es kommt eben auf den Anwendungsfall an, welches Phänomen beschrieben und erklärt werden soll. Um bspw. das Goldfolienexperiment zu erklären reicht das Rutherford’sche Atommodell völlig aus; hierfür Bedarf es kein unnötig komplexes quantenmechanisches Modell.
Modelle sind die Versuche beobachtbare Phänomene innerhalb bestimmter Gültigkeitsgrenzen zu beschreiben.