Als spezifische Verdampfungswärme (Verdampfungsenthalpie) bezeichnet man die zur Verdampfung einer Flüssigkeit notwendige Wärmeenergie pro Kilogramm des Stoffes!
Verdampfungsprozess
Wird eine Flüssigkeit mehr und mehr erwärmt, dann wird irgendwann der Siedepunkt erreicht. In diesem Punkt ändert sich der Aggregatzustand und die Flüssigkeit beginnt schließlich zu verdampfen (auch als Sieden bezeichnet). Während des Verdampfens beobachtet man für Reinstoffe keine weitere Temperaturzunahme, trotzt der weiterhin zugeführten Wärmeenergie. Die Energie kommt während des Verdampfens offensichtlich nicht mehr der Erhöhung der Bewegungsenergie der Teilchen zugute, welche sonst eine Temperaturzunahme bedeuten würde (siehe hierzu auch Artikel Temperatur und Teilchenbewegung).
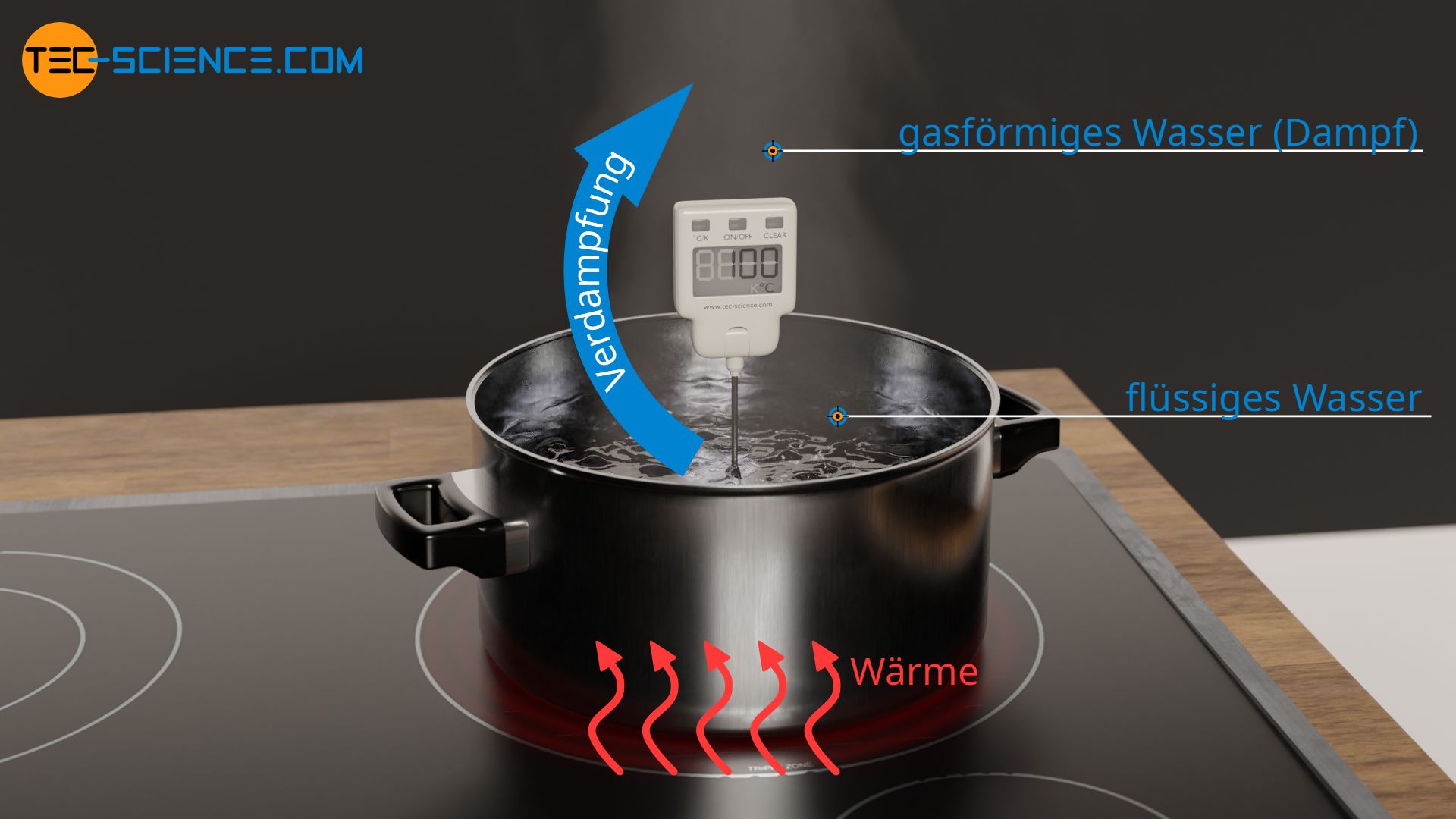
Die zugeführte Energie führt bei einer Verdampfung zur Erhöhung der Inneren Energie in Form von geänderten Bindungsenergien zwischen flüssigem und gasförmigem Zustand. Die intermolekularen Bindungen des flüssigen Zustands werden durch die zugeführte Wärmeenergie sozusagen aufgebrochen und erlauben somit den Übergang in den gasförmigen Zustand. Im gasförmigen Zustand sind die Moleküle aufgrund der geringeren Bindungskräfte nur noch relativ schwach aneinander gebunden.

Während des Verdampfens muss Energie für das Aufbrechen der intermolekularen Bindungen aufgebracht werden. Bei Reinstoffen bleibt die Temperatur der Flüssigkeit dabei solange konstant bis der Verdampfungsprozess vollständig abgeschlossen ist!
Ausführlichere Informationen hierzu finden sich auch im Artikel Warum bleibt die Temperatur bei einer Änderung des Aggregatzustandes konstant?
Dass für einen Verdampfungsvorgang permanent Wärme zugeführt werden muss, um die intermolekularen Bindungen aufzubrechen, zeigt sich zum Beispiel beim Kochen von Wasser. Wird Wasser in einem Topf zum Kochen gebracht, dann verdampft das Wasser nur solange wie die Herdplatte auch eingeschaltet bleibt. Wird die Wärmezufuhr jedoch unterbrochen, dann hört auch das Wasser auf zu sieden.
Es stellt sich die Frage, wie viel Wärme zugeführt werden muss, um eine bestimmte Menge einer Flüssigkeit vollständig zu verdampfen. Die hierfür erforderliche Wärme wird auch als Verdampfungswärme oder Verdampfungsenthalpie bezeichnet. In dieser Verdampfungswärme ist die für die Erwärmung auf Siedetemperatur erforderliche Wärmemenge nicht berücksichtigt. Die Verdampfungswärme beinhaltet somit nur jene zuzuführende Wärmeenergie während des Verdampfens, wenn die Flüssigkeit bereits auf Siedetemperatur erwärmt wurde.
Als Verdampfungswärme (Verdampfungsenthalpie) bezeichnet man die am Siedepunkt einer Flüssigkeit zuzuführende Wärmeenergie, um eine bestimmte Menge des Stoffes vollständig zu verdampfen!
Zum Unterschied zwischen den Begrifflichkeiten Wärme und Enthalpie siehe Artikel Unterschied zwischen Verdampfungswärme und Verdampfungsenthalpie.
Da sich die zugeführte Verdampfungswärme während der Verdampfung nicht direkt in einer Temperaturerhöhung bemerkbar macht, aber dennoch in Form von innerer Energie im verdampften Stoff wiederzufinden ist, bezeichnet man die Verdampfungswärme auch als latente Wärme. Der Begriff „latent“ kommt aus dem Lateinischen und bedeutet „verborgen sein“ oder „nicht direkt in Erscheinung tretend“.
Experimentelle Bestimmung der Verdampfungswärme
Versuchsaufbau
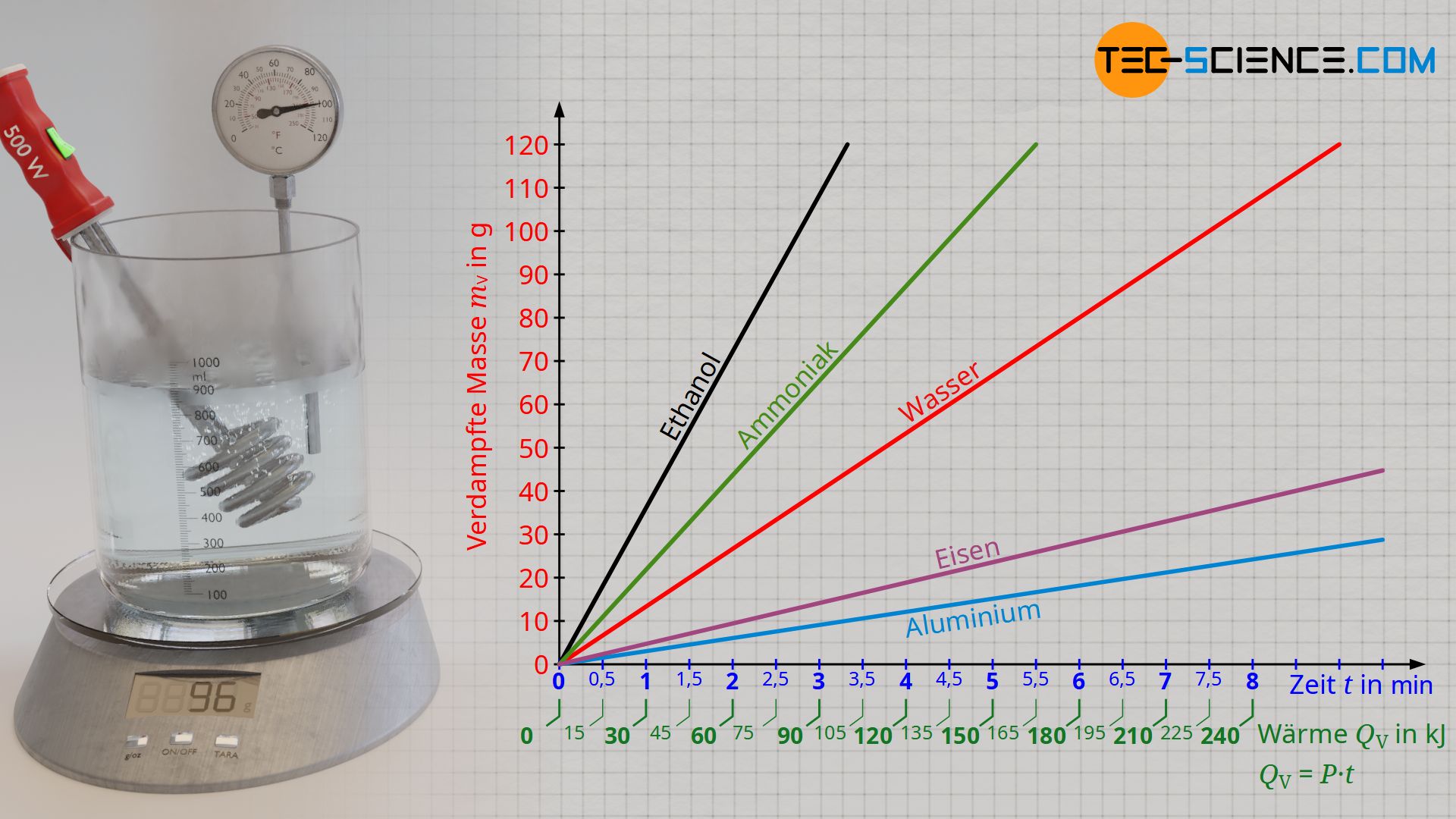
Am Beispiel von Wasser soll im Folgenden exemplarisch die Verdampfungswärme experimentell ermittelt werden, die für das Verdampfen einer bestimmten Menge an Wasser nötig ist. Hierzu wird Wasser mit einem Tauchsieder zunächst auf Siedetemperatur erwärmt. Anschließend wird das zeitliche Verdampfen der Wassermasse anhand einer Waage beobachtet, auf der sich der Versuchsaufbau befindet.
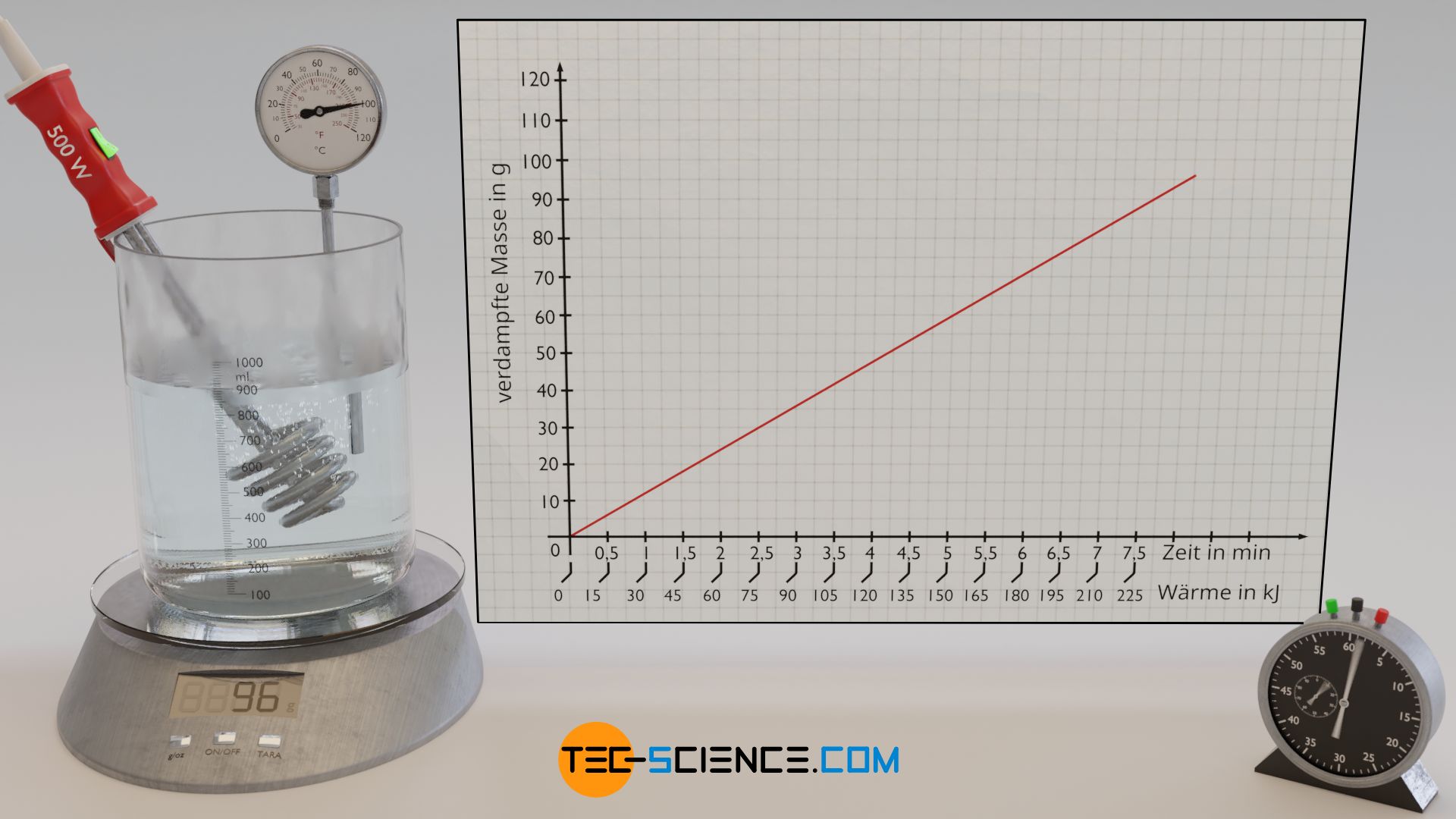
Die zugeführte Verdampfungswärme kann über die elektrische Leistung des Tauchsieders ermittelt werden, die vollständig in Wärmeleistung umgesetzt wird. Die bei einer Leistung P zugeführte Wärmeenergie QV (= Verdampfungswärme) ergibt sich über die Betriebsdauer t des Tauchsieders:
\begin{align}
\label{q}
Q_\text{V} = P \cdot t \\[5px]
\end{align}
Versuchsdurchführung
Zunächst wird das Wasser mit dem Tauchsieder auf Siedetemperatur erwärmt. Beginnt das Wasser zu verdampfen, so kann nun zu einem beliebigen Zeitpunkt das Experiment gestartet werden. Hierzu wird die Waage auf null zurückgesetzt und die Zeitmessung gestartet. Das Wasser verdampft allmählich und die verdampfte Masse wird an der Waage angezeigt. In regemäßigen Zeitabständen wird der angezeigte Wert der Waage erfasst. Zu jedem Zeitpunkt t kann mit Hilfe von Formel (\ref{q}) die bis dahin zugeführte Verdampfungswärme QV ermittelt werden. Auf diese Weise erhalt man eine Aussage welche Wärmemenge zur Verdampfung welcher Masse mV führte.
Versuchsauswertung
Stellt man die verdampfte Masse in Abhängigkeit der Verdampfungswärme dar (Verdampfungskurve), dann zeigt sich ein proportionaler Zusammenhang. Dies bedeutet anschaulich, dass beispielsweise das Verdampfen einer doppelten Wassermenge auch die doppelte Verdampfungswärme erfordert. So zeigt sich durch die Versuchsauswertung, dass für das Verdampfen einer Wassermasse von 48 g offensichtlich eine Verdampfungswärme von rund 120 kJ zuzuführen ist. Bei einer zugeführten Wärmeenergie von etwa 240 KJ ist dann schließlich auch eine doppelte Wassermasse von 96 g Wasser verdampft.
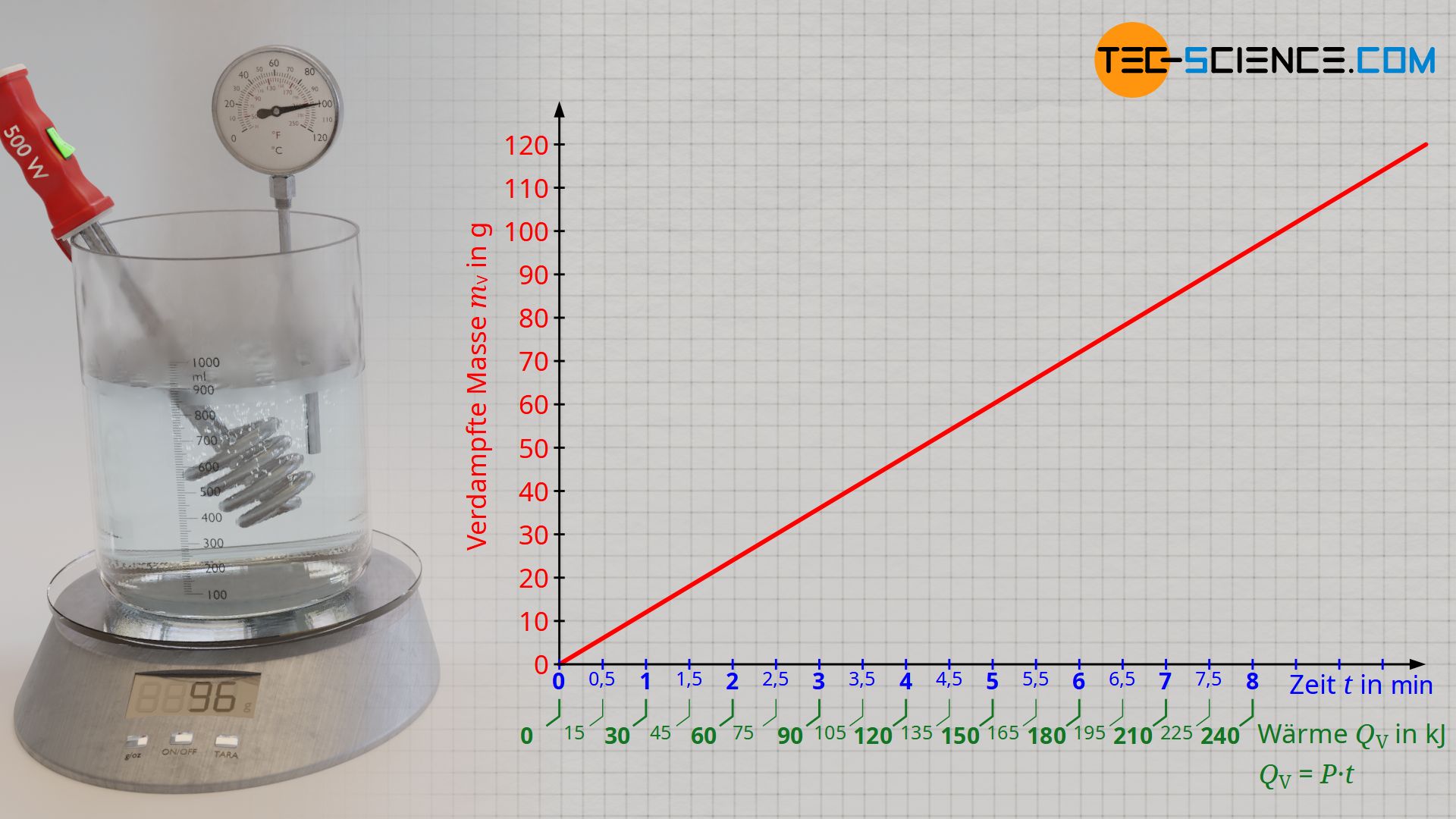
Vor allem im Hinblick auf die Vergleichbarkeit der Verdampfungswärmen verschiedener Flüssigkeiten macht es deshalb Sinn, die Verdampfungswärmen QV immer auf eine einheitliche zu verdampfende Flüssigkeitsmenge mV zu beziehen (z.B. 1 Kilogramm). Dieses konstante Verhältnis zwischen von Verdampfungswärme und zu verdampfender Masse wird als spezifische Verdampfungswärme oder als spezifische Verdampfungsenthalpie qV bezeichnet:
\begin{align}
&\boxed{q_\text{V} = \frac{Q_\text{V}}{m_\text{V}}}~~~[q_\text{V}]=\frac{\text{J}}{\text{kg}}~~~~~\text{spezifische Verdampfungswärme} \\[5px]
\end{align}
Aus dem Versuch erhält man für Wasser schließlich eine spezifische Verdampfungswärme von rund 2500 kJ/kg. Anschaulich bedeutet dies, dass für das Verdampfen einer Wassermasse von 1 Kilogramm eine Wärmeenergie von 2500 kJ nötig ist. Bei der experimentell ermittelten Verdampfungswärme des Wassers anhand des beschrieben Versuchsaufbaus muss jedoch beachtet werden, dass die abgegebene Wärme des Tauchsieders nicht vollständig der Verdampfung des Wasser zugutekommt. Die Wärme wird teilweise auch für die Erwärmung des Gefäßes genutzt und geht somit als Wärmeverlust auf die Umgebung über. Für die reine Verdampfung des Wassers ist folglich eine geringere Wärmemenge erforderlich als mit Formel (\ref{q}) zugrunde gelegt worden ist. Der Literaturwert für die spezifische Verdampfungswärme von Wasser liegt deshalb mit 2257 kJ/kg etwas niedriger.

Als spezifische Verdampfungswärme bezeichnet man die pro Kilogramm einer zu verdampfenden Flüssigkeit zuzuführende Verdampfungswärme!
Schlussfolgerung
Die spezifische Verdampfungswärme qV beschreibt den gesuchten Zusammenhang zwischen der zu verdampfenden Masse mV und der hierfür zuzuführenden Verdampfungswärme QV:
\begin{align}
&\boxed{Q_\text{V} = q_\text{V} \cdot m_\text{V}} ~~~\text{Verdampfungswärme} \\[5px]
\end{align}
Im Falle von Wasser ist die zuzuführende Verdampfungswärme mehr als fünf Mal so groß wie jene Wärmemenge, die für die Erwärmung des Wasser von 0 °C auf 100 °C hatte aufgewendet werden müssen. Diese relativ große Verdampfungswärme ist unter anderem ein Grund weshalb sich ein Feuer hervorragend mit Wasser löschen lässt.
Spezifische Verdampfungswärme ausgewählter Flüssigkeiten
Führt man den oben beschriebenen Versuch anstelle mit reinem Wasser mit einem Wasser-Alkohol-Gemisch oder mit anderen Flüssigkeiten durch (z.B. Metallschmelzen, die verdampft werden), dann zeigt sich, dass die Stoffe unterschiedlich schnell verdampfen. Demzufolge ist mehr oder weniger Wärmeenergie erforderlich, um eine bestimmte Masse des jeweiligen Stoffes zu verdampfen. Die spezifische Verdampfungswärme ist also stoffabhängig.
Je größer die spezifische Verdampfungswärme eines Stoffes, desto mehr Wärme ist nötig, um eine bestimmte Masse zu verdampfen. Stoffe mit großen spezifischen Verdampfungswärmen verdampfen also bei Wärmezufuhr nicht so schnell. Die Verdampfungskurven im Diagramm verlaufen entsprechend flacher. In der unteren Tabelle sind die spezifischen Verdampfungswärmen ausgewählter Flüssigkeiten angegeben.
Dabei muss beachtet werden, dass die spezifischen Verdampfungswärmen indirekt durch den äußeren Luftdruck beeinflusst werden, da sich hierdurch die Siedetemperaturen ändern (siehe hierzu auch Artikel Warum kocht Wasser in großen Höhen früher?)! Da die meisten Verdampfungsvorgänge jedoch bei Umgebungsdruck von 1 bar durchgeführt werden, bezieht sich die spezifische Verdampfungswärme meist auf die Siedetemperatur bei 1 bar.
| Stoff | Siedetemperatur in °C bei 1 bar | Spezifische Verdampfungswärme in kJ/kg |
|---|---|---|
| Feststoffe | ||
| Aluminium | 2450 | 10500 |
| Blei | 1750 | 870 |
| Eisen | 2865 | 6300 |
| Flüssigkeiten | ||
| Ethanol | 78 | 845 |
| Quecksilber | 357 | 290 |
| Wasser | 100 | 2257 |
| Gase | ||
| Ammoniak | -33 | 1370 |
| Butan | -1 | 380 |
| Propan | -42 | 430 |
Beachte, dass nicht bei allen Flüssigkeiten die Temperatur während einer Verdampfung konstant bleibt! So verdampft zum Beispiel Petroleum als Gemisch verschiedener Stoffe nicht bei einem fest definierten Siedepunkt, sondern innerhalb eines Siedebereichs. Dieser liegt im Falle von Petroleum bei 180 °C bis 330 °C. Die zugeführte Wärme während der Aggregatzustandsänderung wird also sowohl für die Erhöhung der Temperatur als auch für den Verdampfungsprozess genutzt. Damit lässt sich nicht genau zuordnen welcher Anteil der zugeführten Wärme nun der Temperaturerhöhung bzw. der Verdampfung zugutekommt. Somit kann einem solchen Stoffgemisch auch keine (spezifische) Verdampfungswärme zugeordnet werden. Im Allgemeinen tritt ein solcher Siedebereich bei Stoffgemischen auf, während hingegen Reinstoffe in der Regel einen Siedepunkt aufweisen.